Nils Von Hentig, Frankfurt
PrEP aus pharmakologischer Sicht
Ein Medikament, welches als PrEP-Substanz eingesetzt werden soll, braucht
- eine gute Gewebegängigkeit insbesondere ins Gewebe des Genitaltrakts,
- eine lange Halbwertszeit,
- eine geringe Plasma-Eiweißbindung,
- eine hohe Affinität für zelluläre Influxtransporter.
Mehrere antiretrovirale Substanzen kommen hier in Frage (Abb. 1)
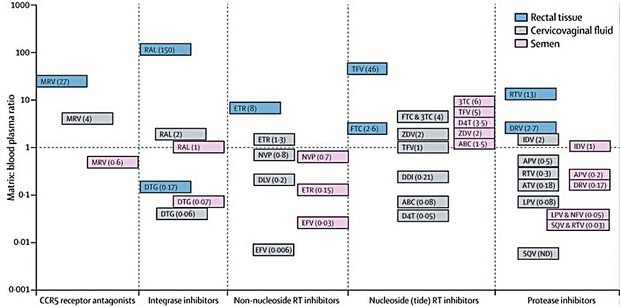
Abb. 1 Antiretrovirale Substanzen mit guter Plasma-Gewebe-Ratio, aufgeschlüsselt nach Sub - stanzgruppen und Geweben. Im Speziellen interessiert das Verhältnis zwischen Plasma und den männlichen/weiblichen Geschlechtsorganen/Genitaltrakt. Dabei fällt auf, dass die Konzentrati - onen vaginal im allgemeinen niedriger liegen als rektal
Tenofovir
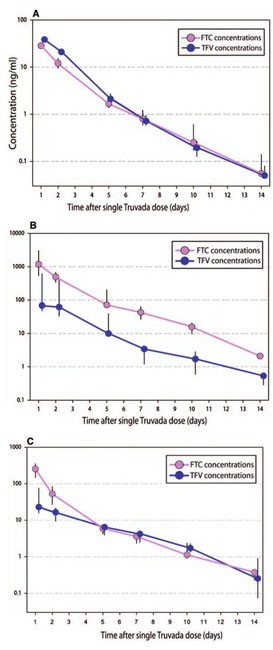
Abb. 2 Konzentrationen von Emtricitabine (FTC) und Tenofovir (TFV) nach Einnahme von Tenofovirdisoproxilfumarat/Emtricitabin (TDF/FTC) in Schleimhautgewebe: (A) Rektal (B) Vaginal (C) Zervikal (Die mittlere Hemmkonzentration 95%, ist 20 (6.8-35) ng/ml)
Daten aus den großen PrEP-Studien, wie iPREX belegen, dass Tenofovirdisoproxilfumarat/Emtricitabin (TDF/FTC, Truvada®) bei ausreichender Adhärenz zur PrEP geeignet ist. Die erreichten Konzentrationen von Tenofovir (TFV) und FTC in der Vaginal- bzw. Rektumschleimhaut waren ausreichend, um Wildtyp HIV-1 zu hemmen (Abb. 2). Allerdings war die Konzentration in der Studie bei selbst guter Adhärenz in Vaginalsamples geringer als in Rektumschleimhaut, dafür gab es bei den beteiligten Männern eine etwas höhere Rate an Therapieabbrüchen.
In einer Substudie der HPTN 052-Studie erhielten die Teilnehmer eine Einzeldosis TDF/FTC. Danach wurden für mehrere Tage TFV- und FTC-Konzentrationen im Blutplasma gemessen (Abb. 3). Die Ergebnisse zeigen folgendes*:
- TFV und FTC konnten auch 14 Tage nach Einnahme noch im Plasma nachgewiesen werden.
- Die AUC von 24h bis 14 Tage nach Einnahme von TFV war für FTC im Genitaltrakt etwa 27-fach höher als diejenige im Blut.
- Die AUC von 24h bis 14 Tage nach Einnahme von TDF/FTC war für TFV im Genitaltrakt nur etwa 2,5-fach höher als diejenige im Blut.
- Rektale Gewebekonzentrationen von TFV/TFV-DP waren ca. 27-fach höher als die Plasma-Exposition in dieser Zeit.
- Rektale Gewebekonzentrationen von TFV-DP waren etwa 100-fach höher als diejenigen in Vaginal- und Zervixgewebe.
- Rektale Gewebekonzentrationen von FTC waren nur etwa 10- bis 15-fach höher als diejenigen in Vaginal- und Zervixgewebe.
- TFV und TFV-DP konnten über 14 Tage in allen Geweben nachgewiesen werden.
- Im Gegensatz zu den hohen Konzentrationen von FTC, konnte FTC-TP nur etwa 2 Tage in den entsprechenden Geweben gemessen werden.
(*TFV=Tenofovir; TFV-DP=TDF-Diphosphat, der intrazellulär aktive Metabolit; FTC=Emtricitabine, FTC-TP=FTC-Triphposphat, der intrazellulär aktive Metabolit).
Diese Resultate zeigen, dass weitere pharmakologische Studien bei der Suche nach einem für die PrEP gleichermaßen für alle geeigneten Mittel gebraucht werden. Die jetzigen PrEP-Regime schützen Männer, die Sex mit Männern haben, jedoch in wesentlich geringerem Maß heterosexuelle Frauen. Ein Grund dafür mag die verschiedenartige Beschaffenheit von rektaler und vaginaler Schleimhaut sein. Ein Weg zu einem besseren Schutz für Frauen könnte deshalb die gleichzeitige Anwendung von oralen Tabletten zusammen mit einem 1%igen TDF-haltigen Vaginalgel, wie z.B. in der CAPRISA 004-Studie. In dieser Studie waren die vaginalen Gewebskonzentrationen von TFV-DP etwa 100-fach höher als in der HPTN 025-Studie und in etwa vergleichbar mit den rektalen Gewebekonzentrationen.
Zu Tenofoviralafenamid (TAF) im Rahmen der PrEP liegen bislang nur sehr wenige Daten vor. Pharmakokinetische Untersuchungen an Gesunden zeigten einen im Vergleich zu TDF deutlich geringeren Serum- und Gewebespiegel, obwohl die intrazellulären Konzentrationen (PBMCs) bekanntermaßen um das 7-fache höher liegen als bei Einnahme von TDF: Nach Einnahme einer Dosis von TAF 25 mg waren die Tenofovir-Konzentrationen über 48 Stunden 13-fach niedriger in Rektumschleimhaut und etwa halb so niedrig im weiblichen Genitaltrakt gegenüber der herkömmlichen TDF-Formulierung. In einer Studie mit Makaken schützte TAF/FTC jedoch alle Affen vor einer HIV-Infektion, so dass eine gültige Aussage zu TAF als mögliche Substanz in der PrEP nicht getroffen werden kann, bevor weitere Studien stattgefunden haben. Es wird derzeit nicht empfohlen, eine PrEP mit TDF/FTC durch TAF/FTC zu ersetzen.
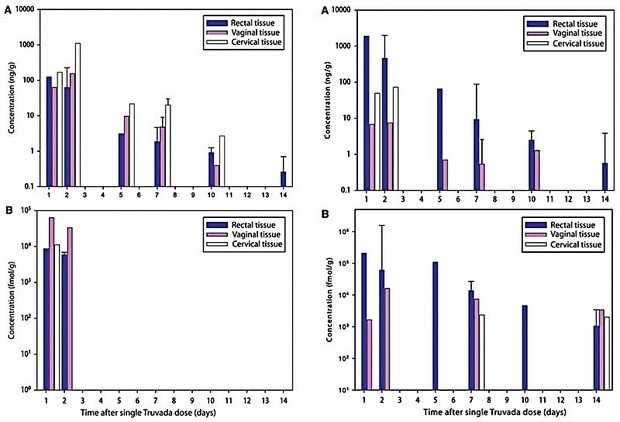
Abb. 3 Mediane Konzentrationen von (1) TFV/TFV-DP (ng/g) und (2) FTC/FTC-TP (fmol/g) Rektal (dunkelblau), Vaginal (lila), und Zervikal (weiß) Schleimhaut über 14 Tage nach einer einmaligen Dosis von TVD. Vertikale Linien repräsentieren den Interquartilen-Bereich. Die Proben wurden mithilfe von LC-MS/MS analysiert
Maraviroc
Maraviroc wurde bei Männern und Frauen untersucht. Hierbei wurden Serum-, Vaginalschleimhaut und Rektalschleimhaut-Konzentrationen gemessen. Zwei Stunden nach der Einnahme einer Standard-Dosis Maraviroc (300 mg) wurden protektive Schleimhautkonzentrationen gemessen, welche ca. 30x höher als die Plasmakonzentrationen waren. In der Phase-2-Studie HPTN 069/ACTG 5305, in der Maraviroc 300 mg OD allein oder mit TDF bzw. FTC bzw. TDF/FTC bei MSM geprüft wurde, war in einer Substudie das Potential der Virussuppression im Rektalgewebe bei Maraviroc allein signifikant geringer. Die CHARM 03-Studie, eine randomisierte, offene, Cross-Over Pharmakokinetik-Studie, läuft noch. Hier wird Maraviroc 300 mg oral sowie ein1%iges Maraviroc-Gel (FDA NCT0234 6084) vaginal bzw. rektal eingesetzt.
Raltegravir
Auch
der Integraseinhibitor (INI) Raltegravir zeigt in einem Vergleich
zwischen Blut-, Vaginalschleimhaut-, und
Rektalschleimhaut-Konzentrationen gute Ergebnisse. Verglichen mit der
Halbwertszeit im Blut von etwa 7h, war die Halbwertszeit im
Vaginalsekret etwa 17h nach einer Standard-Dosis von 400 mg
Raltegravir. Die Konzentrationen in Rektalproben ist dabei noch höher
als die in Vaginalschleimhaut.
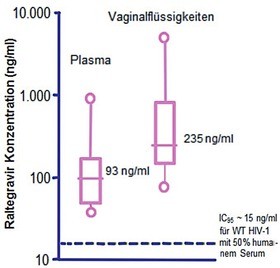
Abb. 4 Konzentration von Raltegravir im Vaginalsekret nach Einnahme einer Standarddosis 400 mg im steady state 5h nach Einnahme.
In der multizentrischen DIVA-Studie wurde der Übergang antiretroviraler Medikamente in den weiblichen Genitaltrakt bei Frauen unter ART untersucht. An der DIVA01-Substudie nahmen 14 HIV-1 infizierte Frauen unter Raltegravir 400 mg BID (HIV-1-RNA<40 Kopien/ml seit ≥3 Monaten) teil. Die mediane Raltegravir-Konzentration in der Vaginalflüssigkeit überschritt die IC95 für Wildtyp HIV-1 um das 16-fache, wobei die Plasma/Vaginalsekret-Ratio ~1:2.8 betrug (Abb. 4).
Dolutegravir
Bei dem INI Dolutegravir waren die Konzentrationen in pharmakokinetischen Untersuchungen verglichen mit Blutplasma um 7% in Samenflüssigkeit bzw. um 17% in rektalem Gewebe höher. Damit lagen die Konzentrationen im Rektumgewebe etwa 2-fach höher wie die Protein-adjustierte HIV-1 Wildtyp IC90. In einer Studie an acht gesunden Frauen, die DTG 50 mg für 5-7 Tage erhielten, wurden in dieser Zeit jeweils 11 gepaarte Blutplasma- und Vaginalsekretproben gemessen, sowohl nach der ersten Dosis als auch nach multipler Dosierung. Die Dolutegravir-Konzentrationen in den Vaginalproben betrugen ca. 6-7% nach Einzeldosierung bzw. 9-10% nach Mehrfachdosierung in der Vaginalflüssigkeit verglichen mit Blutplasma; damit lagen 94% der Konzentrationen über der Protein-adjustierten HIV-1 Wildtyp IC90.
Cabotegravir
Cabotegravir, ein Analogon von Dolutegravir, kann oral und intramuskulär gegeben werden. Die orale Gabe erfolgt einmal täglich. Die Halbwertszeit nach intramuskulärer Gabe liegt bei 40 Stunden. Die Applikation als Nanosuspension verlängert die Halbwertszeit erheblich, so dass eine intramuskuläre Gabe 4- bis 12wöchentlich möglich scheint. In einer ersten klinischen Studie, in der Cabotegravir alle 8 oder 12 Wochen injiziert wurden, stieg die Serumkonzentration schneller als die pharmakokinetischen Modelle vorher gesagt hatten, was zu höheren maximalen und niedrigeren Talspiegel führte als erwartet. Die Entwicklung der Substanz wird voraussichtlich mit 8wöchigen Injektionen weitergeführt.
L-870812
L-870812 (L-812) ist ein potenter. dessen Effektivität im Tiermodell bei Makaken belegt ist. Für eine PrEP haben INI die positive Eigenschaft, dass sie das postkoitale Fenster der Virushemmung deutlich verlängern könne. Raltegravir und L-812 sind gleichermaßen potent gegenüber der SIV- und der HIV-Integrase mit einer IC50 (50% inhibitory concentration) im nanomolaren Bereich (1 bis 4 nM). Das ermöglicht aufgrund der ähnlichen Eigenschaften mithilfe von L-812 im Makaken-Modell die medikamentöse Prophylaxe der HIV-Infektion sowohl vor als auch nach Exposition zu testen.
Topische PrEP
Neben der oralen bzw. intramuskulären Applikation von antiretroviralen Substanzen zur PrEP wird schon seit langem nach Möglichkeiten der topischen PrEP, d.h. der lokalen Anwendung, gesucht. Zunächst wurden die sogenannten “Mikrobizide” für Frauen entwickelt. Mittlerweile sind auch einige Gels zur rektalen Applikation in der Prüfung.
Topische Integrasehemmer
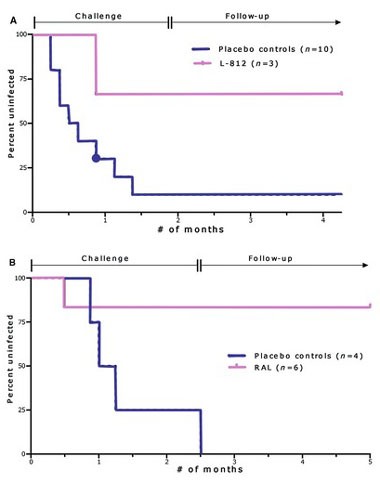
Abb. 5 Die Überlebenskurve repräsentiert den kumulativen Prozentanteil von nicht-infizierten Makaken über die Zeit unter Risiko einer Infektion über die Monate unter Risiko (8 Risikoereignisse im Monat) (A) Gel mit L-812 (lila Linie) oder Plazebo (blaue Linie) wurde vaginal appliziert, 30 Minuten vor jeder SHIV Exposition (bis zu 14 SHIV Expositionen). Die Proben beinhalten eine Echtzeit-Kontrolle (lila Linie) und neun historische Kontrollen (blaue Linie). (B) Gel mit RAL (lila Linie) oder Placebo (blaue Linie) wurde vaginal 3h nach SHIV-Exposition gegeben (bis zu 20 SHIV Expositionen)
In vitro bleibt die antivirale Aktivität von Raltegravir-Gel in Gegenwart von Vaginalflüssigkeit erhalten. Dies wurde mittels einer TZM-bl reporter Zelllinie gemessen. Im Makaken-Modell schützte Raltegravir-Gel ebenso wie L-812-Gel die Tiere vor SIV nach einer vaginalen Exposition (Abb. 5). Ergebnisse aus Tier-Modellen sind natürlich nicht 1:1 auf den Menschen übertragbar. Dennoch können diese Modelle helfen, die jeweilige Kinetik im Gewebe zu verstehen, die Wirksamkeit zu beurteilen und eine Wahl zu treffen, ob Studien am Menschen vertretbar sind.
Topisches Tenofovir
Die CHARM-Studien untersuchen derzeit die Wirksamkeit und Pharmakokinetik von verschiedenen Tenofovir-Gel-Formulierungen (CHARM 01) in An- oder Abwesenheit von Verhütungsmitteln (CHARM 02). Erste Ergebnisse werden in Kürze erwartet.
Intravaginaler Ring
Auch intravaginale Ringe (IVR), die den Wirkstoff über längere Zeit kontinuierlich abgeben (pod-IVR), werden derzeit erprobt. Eine neuere Technik erlaubt hierbei die gleichzeitige Abgabe mehrerer Substanzen, z.B. von TDF, FTC und Maraviroc über 28 Tage. Die medianen steady-state Konzentrationen nach Gabe von TDF/FTC betrugen 30µgr/g Gewebe für TFV und 500µgr/g Gewebe für FTC in der TDF/FTC-Gruppe sowie 10µgr/g Gewebe für TFV und 150µgr/g Gewebe für FTC und 20µgr/g Gewebe für MVC in der TDF/FTC/Maraviroc-Gruppe. Bei Makaken wurden keine unerwünschten Ereignisse beobachtet, lediglich eine leichte bis moderate Erhöhung inflammatorischer Marker im Vaginalbereich sowohl unter Therapie als auch ohne eine solche. Die Vaginalflora wurde durch die IVRs nicht gestört.
Dapivirin
Die Wirksamkeit eines Dapivirin-IVR wurde in der placebokontrollierten ASPIRE-Studie an über 2500 afrikanischen Frauen untersucht. Die Frauen benutzten 32 Monate einen monatlichen IVR mit retardierter Abgabe von Dapivirin oder Placebo. Die Ergebnisse waren eindeutig. Die Inzidenz von HIV-Neuinfektionen war in der Verum-Gruppe (n=71) um 27% niedriger als in der Placebo-Gruppe (n=97; p=0.05). Der Unterschied war beiden jüngeren Frauen <21 Jahren sogar noch deutlicher ausgeprägt und mit der Adhärenz korreliert. Dapivirin-Plasmakonzentrationen sowie die im IVR verbleibende Konzentration an Dapivirin wurden gemessen und als Adhärenzmarker eingesetzt. Die Plasmakonzentrationen von Dapivirin in der Substudie betrugen im Mittel 95 pg/mL. Bereits in präklinischen Versuchen wurden Dapivirin-Konzentrationen in Vaginalsekret gefunden, die das 15.000-fache der mittleren IC50 für Wildtyp HIV-1.
Bereits eine Vorläuferstudie hatte eine Korrelation zwischen Dapivirin-Konzentrationen im Plasma und residualem Dapivirin im IVR gefunden: Im Mittel wurden über das 28-tägige Dosisintervall 4 mg Dapivirin freigesetzt und Plasmakonzentrationen von <200pg/mL waren mit einer geringeren Freigabe, d.h. möglicherweise schlechterer Adhärenz verbunden. Eine Korrelation von Plasmaspiegeln, IVR-Residualkonzentration und Wirksamkeit konnten in dieser Studie in 280 Frauen aus Südafrika, Malawi und Tansania jedoch nicht festgestellt werden.







 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
