Johanna Bolay und August Stich, Würzburg
Die Japanische Enzephalitis
Grundlagen
Die Japanische Enzephalitis (JE) ist eine Zoonose. Erreger ist ein RNA-Virus aus der Gattung der Flaviviren. Das JE-Virus (JEV) wird in 5 verschiedene Genotypen eingeteilt, die in den einzelnen Regionen mit unterschiedlicher Verteilung auftreten.4
Abb. 1 Eine Culex spec. bei der Blutmahlzeit
Das Reservoir des Virus sind Schweine und Wasservögel, wie zum Beispiel Enten und Reiher. Die Übertragung erfolgt über dämmerungs- und nachtaktive Stechmücken, vor allem der Gattung Culex (Abb. 1). Diese brüten in Feuchtgebieten wie zum Beispiel Reisfeldern und sind daher vor allem in ländlichen Gebieten beheimatet. Menschen können durch den Stich der Stechmücken infiziert werden. Die Viruslast bei Menschen bleibt jedoch so gering, dass eine weitere Übertragung des Virus durch eine Stechmücke von Mensch zu Mensch oder zurück zum Tier nicht möglich ist. Der Mensch ist für das Virus ein „dead end“2 (Abb. 2)5.
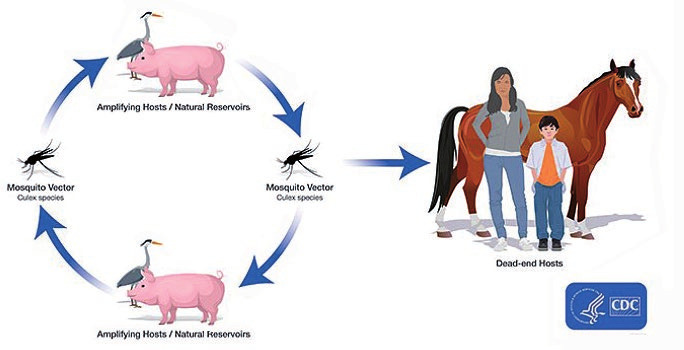
Abb. 2 Transmissionszyklus der Japanischen Enzephalitis 5
Epidemiologie
Erstmals beschrieben wurde das Virus in den 30er Jahren in Japan.6 Anschließend konnte es in vielen weiteren asiatischen Länder nachgewiesen werden. Es findet sich endemisch im süd-, südost- und ostasiatischen Raum (Abb. 3). In Japan werden inzwischen nur noch wenige Fälle auf den südlichen Inseln registriert, woanders ist die JE aber ein großes Gesundheitsproblem für die ländliche Bevölkerung. Während in Ländern mit gemäßigtem Klima (z.B. China, Japan, Nepal) die Infektionen vor allem während und nach der Regenzeit auftreten, finden in Ländern mit tropischem Klima (z.B. Kambodscha, Indonesien, Vietnam, Thailand) Infektionen über das ganze Jahr hinweg statt, wobei auch hier ein Anstieg der Infektionsrate während der Regenzeit zu verzeichnen ist.2,5 In Ländern, in denen JEV endemisch auftritt, sind vor allem Kinder unter 15 Jahren betroffen, da nach Virusexposition protektive Antikörper entwickelt werden.2,7 Informationen für einzelne Länder bezüglich der Hauptinfektionszeiten der Japanischen Enzephalitis sind auf der Seite der CDC (https://www.cdc.gov/japaneseencephalitis/transmission/index.html) zu finden.5
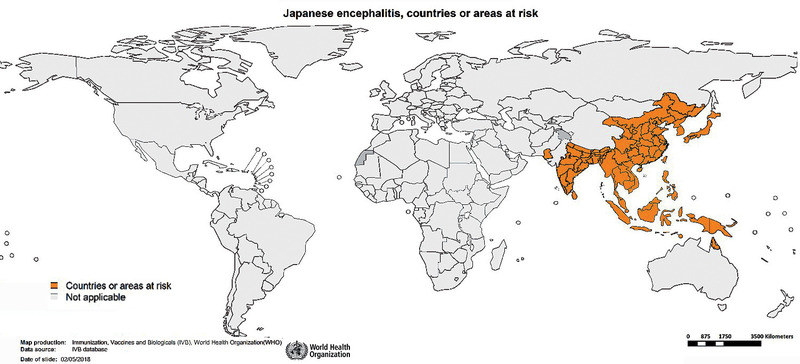
Abb. 3 Von JE betroffene Länder 1
In Australien wurden das JEV 1995 erstmals auf den Torres Strait Inseln im Norden Australiens nachgewiesen. Seitdem trat es dort sporadisch auf.8 Im Jahr 2021/2022 wurde dann ein Ausbruch von JE bei Schweinen in 54 Schweinezuchtbetrieben an der Ost- und Südküste beobachtet9, nachdem es dort durch globale Klimaphänomene zu vermehrten Regenfällen gekommen war. Dabei kam es auch zu vektorübertragenen Infektionen von Menschen. Bis Januar 2023 wurden insgesamt 45 humane JEV-Infektionen nachgewiesen, von denen 7 tödlich endeten.8
Klinisches Bild
Meist verläuft eine Infektion mit JEV asymptomatisch oder mit Symptomen eines unspezifischen fieberhaften Infekts.2 In weniger als einem Prozent aller Infektionen kommt es nach einer Inkubationszeit von 5-15 Tagen zu neurologischen Symptomen. Typisch ist ein doppelgipfliger Verlauf mit zunächst Fieber, Kopfschmerzen und Erbrechen.5 In der Folge können weitere neurologische Funktionsstörungen wie kognitive Einschränkungen sowie fokal neurologische Defizite wie Paresen, Hemiplegien oder Funktionsstörungen von Hirnnerven auftreten. Zudem kommen schwere Bewusstseinsstörungen bis hin zu komatösen Zuständen vor. Besonders bei Kindern kann es auch zu Krampfanfällen kommen.5 All diese Symptome treten im Rahmen der durch das JEV verursachten Enzephalitis auf. Die Letalität ist im Fall einer manifesten Enzephalitis mit 20-30% sehr hoch.10 Bei den überlebenden Patienten kommt es in etwa der Hälfte der Fälle zu persistierenden kognitiven, neurologischen oder psychiatrischen Funktionsstörungen5,10, so auch bei der Patientin in unserem Fall.
Diagnose und Therapie
Der klinische Fall
Eine 54-jährige Lehrerin kehrt von einer zweiwöchigen Reise nach Bali zurück. Bereits einen Tag vor Rückreise erkrankte sie mit hohem Fieber, den Flug zurück hat sie irgendwie überstanden. Ihrem Mann fällt auf, dass zwar das Fieber leicht rückläufig ist, sie aber jetzt Kopfschmerzen, Konzentrationsstörungen und eine starke Gangunsicherheit entwickelt. Wir sehen eine schwer kranke, febrile, leicht desorientierte Patientin mit ausgeprägter Ataxie. Im Labor zeigen sich erhöhte Entzündungswerte bei normaler Leukozytenzahl, Dengue-Schnelltest und Malaria-Diagnostik sind negativ.
In den Folgetagen verschlechtert sie sich: ausgeprägte Wortfindungsstörungen, Dyslexie, Dyskalkulie und eine deutliche Wesensveränderung. Die zerebrale Bildgebung (MRT) zeigt zwar ein unauffälliges Ergebnis, die Lumbalpunktion aber ein entzündliches Liquorbild mit leichter Lymphozytose und Proteinvermehrung. Noch viele Monate später leidet sie an Konzentrationsstörungen, starker Erschöpfbarkeit, Schwindel und einer Verlangsamung der Sprache, sodass die Wiederaufnahme ihres Berufes als Lehrerin seither nicht mehr möglich ist.
Die Patientin hatte eine Japanische Enzephalitis mit schwerem Verlauf.1,2 Nach nur zwei Wochen Bali, einem klassischen Ziel von jährlich vielen Millionen Touristen aus aller Welt? Das Besondere bei der Reise dieser Patientin waren nicht Strand und Tempelbesuche, sondern ein Nature Trail, eine Woche zu Fuß durch die Insel mit Übernachtungen bei der örtlichen bäuerlichen Bevölkerung in einfachen Unterkünften.3 Das machte den Unterschied.
Der schwierigste Part bei der Diagnose der JE ist: daran denken! Die Anamnese mit einer potenziellen Exposition gegenüber dem JEV sowie die klinische Präsentation der Patienten sind entscheidend. Beim serologischen Nachweis kann es zu einer potentiellen Kreuzreaktion mit anderen Flavivirus-Infektionen kommen, in spezialisierten Labors wie dem Nationalen Referenzzentrum für tropische Virusinfektionen am Bernhart-Nocht-Institut in Hamburg ist eine Differenzierung aber möglich.
Prinzipiell ist auch ein direkter Virusnachweis über die virale RNA durch einen Nukleinsäureamplifikationstest (NAT) möglich, insbesondere in den ersten Krankheitstagen.2 Da die Virusmenge in Blut oder Liquor beim Menschen aber gering und kurzlebig ist, haben diese Teste nur eine eingeschränkte Sensitivität. Bei dringendem Krankheitsverdacht und (noch) negativem Antikörpernachweis kann der Einsatz von NAT in den ersten Krankheitstagen aber sinnvoll sein.11
Bei den orientierenden Blutwerten zeigen sich meist normale bis erhöhte Leukozytenwerte mit prädominanter Lymphozytose sowie eine leichtgradige Anämie und Thrombozytopenie. Darüber hinaus können eine Hyponatriämie und erhöhte Leberwerte auftreten.2
Bezüglich der bildgebenden Diagnostik kommen CT und MRT des Schädels zum Einsatz, wobei sich JEV- assoziierte Veränderungen in verschiedenen Hirnarealen darstellen lassen.12 Am häufigsten kommt es zu Veränderungen im Thalamus13, die allerdings auch bei einer Infektion mit dem Denguevirus auftreten können und daher nicht als pathognomonisch für JEV angesehen werden können.12 Es gibt keine spezifische antivirale Therapie. Die therapeutischen Maßnahmen beschränken sich auf die symptomatische Behandlung von Fieber, Kopfschmerzen, Erbrechen oder Krampfanfällen, im Bedarfsfall auch den Einsatz intensivmedizinischer Maßnahmen bis hin zu einer maschinellen Beatmung bei schweren Bewusstseinseinschränkungen oder respiratorischen Funktionsstörungen.
Prävention
Das JEV wird von Moskitos verschiedener Arten von tierischen Wirten auf den Menschen übertragen. Bei Aufenthalten in Risikogebieten sollte man sich so gut wie möglich vor Moskitostichen schützen. Dies bedeutet eine intensive Expositionsprophylaxe mit dem Tragen entsprechender Kleidung, dem Einsatz von geeigneten Repellentien und dem Gebrauch von Moskitonetzen, die möglichst mit Insektiziden imprägniert sein sollten.
Ferner besteht die Möglichkeit einer Impfung. In Deutschland steht dafür ein Totimpfstoff (inaktivierter Virusstamm SA 14-14-2, adsorbiert an Aluminiumhydroxid: Ixiaro®) zur Verfügung, der gut verträglich ist und ein hohes Maß an Protektion verspricht. Bei der Empfehlung für eine Impfung spielt neben dem Reiseland mit den konkreten Aufenthaltsorten (städtisch, ländlich, Küstenregion, Bergregionen usw.) die Reisedauer (je länger die Reisedauer, desto höher das Exposi-tionsrisiko), die Jahreszeit der Reise aufgrund des saisonal unterschiedlichen Infektionsrisikos sowie die Reiseart (einfacher Reisestil, viele Outdooraktivitäten, Mitarbeit auf Farmen, Treckingurlaub, Standurlaub, Dienstreisen usw.) eine Rolle. Als Regel für die Praxis hat sich das Vorgehen durchgesetzt, Impfungen solchen Reisenden anzubieten, die in Endemiegebieten länger als vier Wochen in ländlichen Gebieten mit Nähe zur einheimischen Bevölkerung sowie während der Haupttransmissionszeit unterwegs sind.3,14
Für eine Grundimmunisierung werden zwei Impfungen im Abstand von mindestens 28 Tagen empfohlen. Für „Last minute Reisende“ im Alter von 18-65 Jahren ist ein Schnellimpfschema mit zwei Impfungen in einem Abstand von 7 Tagen zugelassen. Nach 12-24 Monaten sollte die Impfung dann bei erneuter Exposition einmal aufgefrischt werden und gibt anschließend Schutz für 10 Jahre. Die Impfung ist für Kinder ab 2 Monaten zugelassen, wobei im Alter bis zu 3 Jahren nur die Hälfte des Impfstoffs (0,25 ml) geimpft werden soll.14
Eine kompetente reisemedizinische Beratung ist nicht trivial. Eine Liste der Ärztinnen und Ärzte, die das Zertifikat „Reisemedizin“ führen, ist auf der Seite der Deutschen Gesellschaft für Tropenmedizin, Reisemedizin und Globale Gesundheit zu finden (https://www.dtg.org/index.php/liste-tropenmedizinischer-institutionen/arztsuche.html).
Der One Health Aspekt

Abb. 4 Enge Nachbarschaft von Menschen, tierischen Wirten und Brutstätten für die Vektoren im ländlichen Kambodscha
Zoonosen befinden sich an der Schnittstelle zwischen Human- und Veterinärmedizin. Bei der JE spielen viele Faktoren, wie zum Beispiel die Lebensbedingungen von Mensch und Tier, die Vermehrung und Ausbreitung der Vektoren, aktuelle Wetterverhältnisse und Klimawandel eine große Rolle (Abb. 4). Das One Health Konzept ist ein interdisziplinärer Ansatz mit dem Ziel, die Gesundheit von Menschen und Tieren zu verbessern und die umgebenden Ökosysteme nachhaltig in einem Gleichgewicht zu halten.15
Zusammenfassung
- Die JE ist eine durch Moskitos übertragene gefährliche Zoonose und Hauptursache für Enzephalitiden in Asien.
- Klinische Symptome sind Fieber, Kopfschmerzen und neurologische Störungen.
- Die Diagnostik beruht auf dem klinischen Verdacht und erfolgt serologisch, ggf. auch über einen Virus-Direktnachweis.
- Eine kausale antivirale Therapie gibt es nicht, die Behandlung bleibt symptomatisch.
- Zur Prävention stehen eine konsequente Expositionsprophylaxe und eine Impfung zur Verfügung.
- Im Rahmen des Klimawandels ist mit einer Ausbreitung von Risikogebieten und weiteren Ausbruchsgeschehen zur rechnen.
- Die Bekämpfung der JE erfordert eine enge interdisziplinäre Zusammenarbeit im Sinne des umfassenden One Health-Konzeptes.











 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
