Syphilis/Lues
Siehe auch:
Feinheiten der Labordiagnostik
Transmission
Treponema pallidum aus der Familie der Spirochaetaceae ist der Erreger der Syphilis. Die Bakterien werden am häufigsten durch direkte sexuelle Kontakte übertragen und dringen dabei durch Mikroläsionen der Schleimhaut oder Haut ein. Selbst Küssen kann ansteckend sein! Bei einem einmaligen ungeschützten sexuellen Kontakt beträgt das Übertragungsrisiko zwischen 30 und 60%. Hämatogene oder kongenitale Übertragungen sind in Deutschland selten.
Syphilis und HIV
 Historische Darstellung eines Syphilitikers von Albrecht Dürer aus dem Jahr 1496
Historische Darstellung eines Syphilitikers von Albrecht Dürer aus dem Jahr 1496
Von dem Wiederanstieg der Syphilis-Inzidenz etwa seit dem Jahr 2000 in Deutschland sind überwiegend Männer, die Sex mit Männern haben (MSM), in Großstädten betroffen. Verschiedene Publikationen zeigen unter den Syphilis-infizierten MSM einen verhältnismäßig hohen Anteil von HIV-Koinfizierten.
Befragungen von MSM geben keinen Hinweis auf ein deutlich unterschiedliches sexuelles Risikoverhalten zwischen HIV-negativen und HIV-infizierten MSM. Ob die höhere Inzidenz daher auf ein erhöhtes Transmissionsrisiko einer Syphilis-Infektion bei HIV-Infizierten zurückgeht oder ob HIV-Infizierte von ihren HIV-Schwerpunktbehandlern häufiger auf sexuell übertragbare Erkrankungen untersucht werden als HIV-negative MSM in der medizinischen Regelversorgung, ist derzeit unklar. Im letzteren Fall wären zahlreiche „unentdeckte“ Syphilis-Infektionen unter MSM zu vermuten.
Die Syphilis begünstigt die Übertragung einer HIV-Infektion oder anderer venerologischer Erkrankungen. Die gestörte Barrierefunktion durch Haut- und Schleimhautdefekte vor allem in Primär- und Sekundärstadien der Syphilis erleichtert den Eintritt von HIV. Das entzündliche Infiltrat bei einer Syphilis enthält im betroffenen Gewebe zahlreiche (CD4-positive und CCR5-expremierende) Zielzellen der HIV-Infektion. Die Syphilis-Infektion stellt somit eine Markererkrankung für eine HIV-Infektion dar und jedem Patienten mit Syphilis sollte ein HIV-Test angeboten werden.
Syphilis bei HIV
Während einer Syphilis-Infektion bei HIV-Infizierten fallen die CD4-Zellen im Blut vorübergehend ab und die HI-Viruslast steigt häufig an, selbst wenn der Syphilis/HIV-Koinfizierte bereits effektiv antiretroviral behandelt wurde und die HI-Viruslast zuvor unterhalb der Nachweisgrenze lag. Mit der Ausheilung bzw. erfolgreichen Therapie der Lues verschwinden diese Effekte wieder. Resistenzen gegen die antiretrovirale Therapie treten trotz der vorübergehenden Virämie im Rahmen einer Syphilis-Infektion im Allgemeinen nicht auf.
Klinik
Die Inkubationszeit der Syphilis beträgt im Mittel 14-24 mit einem Bereich von 10-90 Tagen. Etwa 40-50% der Infektionen heilen spontan aus. Bei persistierender Infektion entwickelt sich eine chronisch progrediente Systemerkrankung mit Befall verschiedener Organsysteme, die in zeitlicher Abfolge verschiedene Stadien durchläuft. Diese Stadien können jedoch auch übersprungen oder wiederholt werden. Während der klinisch symptomatischen Stadien der Frühsyphilis (Lues I und II) sowie im asymptomatischen frühen Latenzstadium (<1-2 Jahre nach der Infektion) ist das Übertragungsrisiko einer Infektion am höchsten. Dies gilt insbesondere, wenn im Stadium I ein Primäraffekt vorliegt. In der späten Latenzphase (>1-2 Jahre nach der Infektion) ist die Syphilis nur gering infektiös. Die klinisch symptomatischen Spätstadien (Lues III und IV: 2-50 Jahre post infectionem) gelten als nicht mehr infektiös.
Syphilis I (Primärsyphilis): 2-3 Wochen nach der Infektion tritt an der Inokulationsstelle als Primäraffekt ein Ulcus durum (Harter Schanker, Erosivschanker) auf (Abb. 1). Dieses schmerzlose, derbe Geschwür mit infiltriertem Randsaum, aus dem sich ein klares treponemenreiches Reizsekret gewinnen lässt, wird begleitet von einer meist einseitigen, derben Lymphadenitis, dem so genannten Bubo. Unbehandelt heilt der Primärkomplex nach 4-6 Wochen spontan ab.
Syphilis II (Sekundärsyphilis):
Nach weiteren 4 Wochen bis 6 Monaten treten in Intervallen variable
Allgemeinsymptome auf, darunter Lymphknotenschwellungen und Symptome an
verschiedenen Organen. Nicht selten weisen ansteigende Leberwerte auf eine Lues
II hin. Auch eine okuläre Beteiligung als Episcleritis oder Iritis wird
beobachtet. Die klinische Vielfalt der häufigen Syphilide an Haut und
Schleimhäuten reicht von Exanthemen typischerweise mit palmoplantarer
Beteiligung, Roseolen, über Alopecia syphilitica, Plaques muqueuses, Angina
specifica, Condylomata lata genital und perianal, sowie Pigmentveränderungen
(Leucoderma specificum) bis hin zur Lues maligna (Abb. 2, Abb 3, Abb. 4).
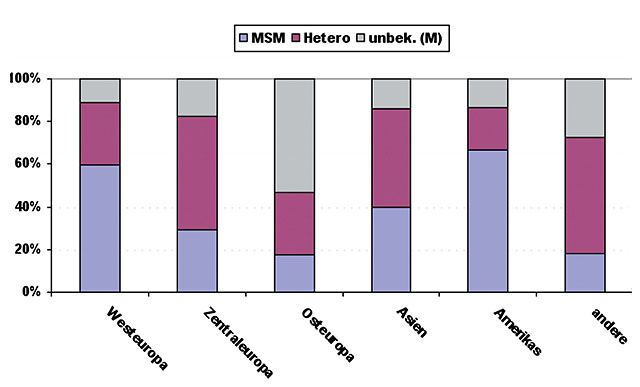 Abb. 2 Anteilige Verteilung der angegebenen Syphilis-Übertragungsrisiken bei Infektion im Ausland, 2011
Abb. 2 Anteilige Verteilung der angegebenen Syphilis-Übertragungsrisiken bei Infektion im Ausland, 2011
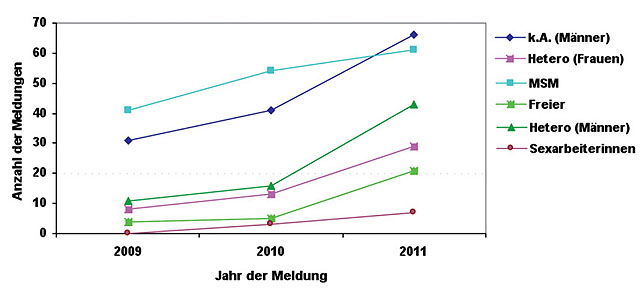 Abb. 3 Syphilis-Meldungen in Dortmund und Umgebung (PLZ-Regionen 44, 58,59) nach Geschlecht und Transmissionsrisiko), 2009-2011
Abb. 3 Syphilis-Meldungen in Dortmund und Umgebung (PLZ-Regionen 44, 58,59) nach Geschlecht und Transmissionsrisiko), 2009-2011
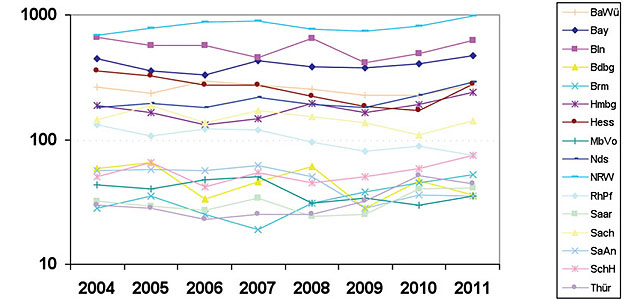 Abb. 4 Zeitlicher Verlauf der Syphilis-Meldungen in den 16 Bundesländern (logarithmische Größenachse!), 2001-2011
Abb. 4 Zeitlicher Verlauf der Syphilis-Meldungen in den 16 Bundesländern (logarithmische Größenachse!), 2001-2011
Nächtliche Kopfschmerzen sprechen für eine frühsyphilitische Meningitis cerebrospinalis. HIV-Infizierte entwickeln öfter und rascher eine frühe Neurosyphilis, weshalb bei entsprechenden Symptomen oder unklarem Infektionszeitpunkt eine Liquorpunktion empfohlen wird.
Syphilis latens seropositiva: In den klinisch symptomlosen Latenzstadien bleibt die Lues serologisch nachweisbar und ein Rezidiv oder Fortschreiten möglich.
Syphilis III (Tertiärsyphilis): Jahre nach der Erstinfektion können so genannte Gummen auftreten, die als tuberöse oder granulomatöse Veränderungen mit der Tendenz zur Ulzeration und narbiger Abheilung jedes Organ befallen können (Abb. 5). Gefürchtet sind granulomatöse Gefäßveränderungen, die zur Mesaortitis lucia mit Aneurysmenbildung und bei Hirngefäßbeteiligung zur Lues cerebrospinalis führen können.
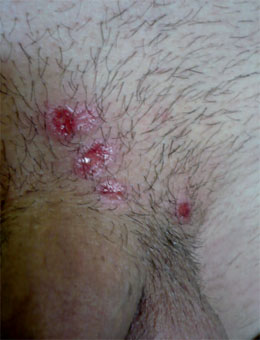 Abb. 1 Mehrere Primäraffekte an der Peniswurzel
Abb. 1 Mehrere Primäraffekte an der Peniswurzel
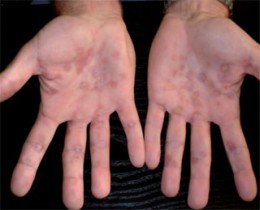 Abb. 2 Typisches Syphilisexanthem der Handflächen320
Abb. 2 Typisches Syphilisexanthem der Handflächen320
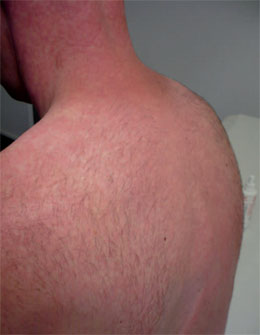 Abb. 3 Syphilisexanthem am Stamm
Abb. 3 Syphilisexanthem am Stamm
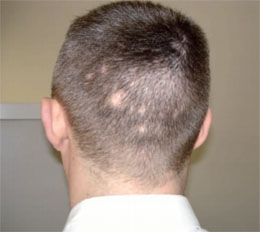 Abb. 4 Alopecia syphilitica
Abb. 4 Alopecia syphilitica
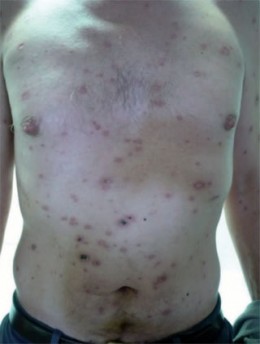 Abb. 5 Lues maligna bereits in Abheilung
Abb. 5 Lues maligna bereits in Abheilung
Syphilis IV (Quartäre Syphilis): Bei unbehandelten Patienten kann nach langjährigem Verlauf eine späte Neurosyphilis auftreten. Mehrere Formen kommen vor. Bei der Tabes dorsalis imponieren einschießende Schmerzen, sensorische Ataxie, reflektorische Pupillenstarre (Argyll-Robertson-Zeichen) und Optikusatrophie. Bei der syphilitischen Meningitis bestehen Hirnnervenparesen, intrakranielle Drucksteigerung und weitere neurologische Symptome. Bei der progressiven Paralyse dominieren Symptome wie Kopfschmerzen, ausgeprägte Persönlichkeitsveränderungen, Sprachstörungen, Krämpfe, Demenz sowie apoplektische Insulte. Eine unbehandelte progressive Paralyse führt nach 4 bis 5 Jahren zum Tode.
Konnatale Syphilis: Die diaplazentare Übertragung erfolgt in der Regel im 4.-5. Schwangerschaftsmonat. Abhängig vom Luesstadium der Schwangeren kommt es entweder zu Abort bzw. Totgeburt oder zur Lues connata des Säuglings mit den beiden Verlaufsformen Lues connata präcox und tarda: Beim Säugling sind die wesentlichen Symptome der Lues connata praecox die Rhinitis syphilitica (Coryza syphilitica), interstitielle Hepatitis, Encephalomeningitis mit Hydrocephalus communicans hypersecretorius, sowie die Parrot-Pseudoparalyse (ulnare Epiphysenlösung durch eine Osteochondritis syphilitica). Die typischen Stigmata der Lues connata tarda (ab dem 3. Lebensjahr) sind: Sattelnase, Parrot-Furchen und Hutchinson-Trias: Tonnenzähne, Keratitis parenchymatosa und Innenohrschwerhörigkeit.
Bei HIV-Patienten zeigt die Syphilis häufiger ungewöhnliche Manifestationen und foudroyante Verläufe (Gregory 1990). Reaktivierungen sowie kürzere Latenzperioden zu den Spätstadien inkl. der Neurosyphilis kommen ebenso vor wie Symptome mehrerer Stadien nebeneinander. Bei 20% der Syphilis/HIV-Koinfizierten konnte bereits während der Frühsyphilis eine Neurosyphilis diagnostiziert werden (Esser 2011). Eine Syphilis kann vorübergehend zu Anstiegen der HI-Viruslast und zur Verschlechterung des Immunstatus führen.
Diagnostik
Bei Verdacht auf einen Primäraffekt ist die Serologie meist noch negativ. Im Reizsekret aus dem Ulcus durum kann der Erreger direkt nachgewiesen werden. Bei der aufwendigen Dunkelfeldmikroskopie des Nativpräparates fallen typischerweise silbern leuchtende, spiralförmige Treponemen durch ihre Rotations- und Knickbewegungen auf. Als erste serologische Reaktion treten IgM-Antikörper auf (Suchtest und Lipoid-Antikörpernachweis noch negativ!). Nicht nur die oft unspezifische Klinik und der atypische Verlauf, sondern auch unzuverlässige Screening-Tests und atypische Luesserologien wie ein späterer IgM-Abfall, schwankende VDRL-Titer (Veneral-Disease-Research-Laboratory-Test, Nachweis von Phospholipid-Antikörpern) erschweren bei HIV-Patienten die Diagnose.
Wegen möglicher Überlappung der Krankheitsstadien sollte jeder Patient mit serologischem Nachweis neurologisch beurteilt werden. Die Indikation zur Liquorpunktion ist großzügig zu stellen, da sie therapeutische Konsequenzen hat (siehe unten). Die Interpretation der Liquorbefunde bei HIV/Lues-Koinfizierten sollte auf der Basis von ITpA-Index (Intrathekal-produzierte Treponema-pallidum Antikörper: TPHA-Titer im Liquor: TPHA-Titer im Serum x IgG im Liquor: IgG im Serum), Parametern einer Schrankenstörung und dem Nachweis einer lymphomonozytären Pleozytose unter Berücksichtigung neurologischer Symptome durch Experten erfolgen.
Luesserologie bei HIV-Infizierten
Die Luesserologie basiert auf treponemenspezifischen Suchtests. Dies sind TPHA (Treponema-pallidum-Hämagglutinationstest), TPPA (Treponema-pallidum-Partikel Agglutinationstest) oder EIA (Enzyme-linked immunosorbent assay). Im positiven Falle folgen treponemenspezifische Bestätigungstests wie IgM-ELISA, IgM- und IgG Westernblot oder 19-S-IgM-FTA-abs (Fluoreszenz-Treponema-Antikörper-Absorptionstest). Bei einem reaktiven 19-S-IgM-FTA-Abs-Test bei unbehandelten Patienten oder eine erneute Reaktivität des Tests bei behandelten Patienten (Lues non satis curata) besteht immer Behandlungsbedarf.
Falsch-negative Testergebnisse können durch eine inadäquate Antikörperproduktion oder durch Unterdrückung der IgM-Produktion bei sehr hohen IgG-Spiegeln auftreten. Im Zweifel sollten daher zusätzlich spezifische Tests wie 19S-IgM-FTA-ABS-Test veranlasst werden, wenngleich auch bei diesen falsch negative Ergebnisse vorkommen. Bei bestätigter Syphilisdiagnostik ist eine (quantitative) Ausgangsbestimmung der nicht treponemenspezifischen Aktivitätsparameter (Lipoidantikörper, z.B. VDRL-Test oder KBR) erforderlich. Diese korrelieren mit der Erkrankungsaktivität der Syphilis. Extrem hohe VDRL-Antikörpertiter können über eine Störung des Antigen-Antikörper-Gitternetzwerkes als Prozonenphänomen zu falsch negativen Testergebnissen führen (Smith 2004). Aus diesem Grund gibt es den Hinweis der Testhersteller, dass die Probe auch in einer höheren Vorverdünnung zu prüfen ist, um dieses Problem zu umgehen. Eine solche Vorverdünnung erfolgt allerdings nicht in allen Laboren regelhaft bei unklarer Luesserologie bzw. „unpassendem“ negativen VDRL-Titer. Deshalb sollte der Klinker sich die Luesserologie genau ansehen. Wenn die Konstellation der Lues-Serologie und der Klinik des Patienten nicht plausibel erscheint, sollte er eine Untersuchung mit entsprechender Vorverdünnung nachfordern oder eine neue Lues-Serologie mit entsprechender Anforderung an das Labor abnehmen, vorausgesetzt es wurde nicht bereits schon mit der Behandlung begonnen. Umgekehrt kann der VDRL-Test auch aufgrund der unspezifischen B-Zell-Aktivierung im Rahmen der HIV-Infektion falsch positiv ausfallen.
Je länger eine unbehandelte Syphilis bestanden hat, desto länger dauert es bis zur Normalisierung der serologischen Befunde nach Therapie. Bei HIV-Infizierten kann selbst nach erfolgreicher Syphilistherapie der IgM-Test noch über Jahre reaktiv bleiben. Ein Therapieerfolg wird während dieser Phase nur durch einen deutlichen Titerabfall der nicht treponemenspezifischen Aktivitätsparameter (Reduktion des VDRL um mindestens zwei Titerstufen innerhalb von drei Monaten) angezeigt. Bei einem Wiederanstieg der zunächst abgefallenen Aktivitätsparameter besteht der Verdacht einer Re-Infektion oder einer Reaktivierung (siehe unten). Eine serologische Differenzierung zwischen Re-Infektion und Reaktivierung ist nicht möglich! Da die Aktivitätsparameter nicht treponemenspezifisch sind, verändern sich diese häufig bei HIV-Infizierten oder zeigen einen atypischen Verlauf, vor allem bei zusätzlichen Infekten, intravenösem Drogengebrauch und Schwangerschaft (Geusau 2005). Fehlinterpretationen von Anstiegen der Aktivitätsparameter können überflüssige Syphilistherapien zur Folge haben. Bei wiederholten Syphilisreaktivierungen sollte eine Liquorpunktion zum Ausschluss einer unbehandelten Neurosyphilis durchgeführt werden.
Therapie
Therapieempfehlung Frühsyphilis
Benzathin-Benzylpenicillin (Pendysin®, Tardocillin®)
2,4 Mio. I.E. i.m. (gluteal li/re je 1,2 Mio.I.E.) (Ý*)
Bei Penicillinallergie:
Doxycyclin 2x 100 mg/Tag p.o.; 14 Tage**
oder
Erythromycin 4x 0,5 g /Tag p.o., 14 Tage
Weitere Alternativen:
Ceftriaxon* 1 g/Tag i.v., Kurzinfusion 30 min, 10 Tage
Ceftriaxon 1 g/Tag i.m., 10 Tage
Tetrazyklin 4x 500 mg/Tag p.o., 14 Tage
Therapieempfehlung Spätsyphilis
Benzathin-Benzylpenicillin (Pendysin®, Tardocillin®)
2,4 Mio. I.E. i.m. (gluteal li/re je 1,2 Mio. I.E.) Tag 1, 8, 15
Bei Penicillinallergie:
Doxycyclin 2x 100 mg/Tag p.o.; 28 Tage**
Erythromycin 4x 500mg/Tag i.v. 28 Tage
Alternativen:
Ceftriaxon (Rocephin® u.a.) 2 g/Tag i.v. Kurzinfusion 30 min, 14 Tage
Therapieempfehlung Neurosyphilis
Penicillin G kristalloide Lsg. (1. Wahl)
6x 3-4 Mio IE/Tag i.v., mindest. 14 Tage
oder (gleichwertig) „ „
3x 10 oder 5x 5 Mio IE/Tag i.v., mindestens 14 Tage *
oder Ceftriaxon
1x 2 g/Tag i.v. über 10-14 Tage (initial 4g) **
Alternative (3. Wahl):
Doxycyclin 2x 200 mg/Tag über 28 Tage (K.I.: Kinder, Schwangere)
Therapieempfehlung bei HIV-Infizierten
Prinzipiell wie bei immunkompetenten Patienten stadiengerecht mit Penicillin!
Ab Sekundärsyphilis erhöhtes Risiko für Neurosyphilis:
»» Benzathin-Penicillin G nur nach möglichst sicherem Ausschluss einer neurologischen Beteiligung (Klinik und Lumbalpunktion!)
Alternativ Ceftriaxon 2 g über 10-14 Tage i.v.
»» Im Zweifelsfall (keine Liquordiagnostik): Therapie wie Neurosyphilis
Quelle: Leitlinien Diagnostik und Therapie der Syphilis der Deutschen STD-Gesellschaft
Die Generationszeit von Treponema pallidum beträgt 30-33 Stunden. Deshalb sollte die Therapiedauer mit treponemiziden Spiegeln 10-11 Tage nicht unterschreiten. Die Therapie der Syphilis richtet sich nach dem Stadium der Erkrankung. Die parenterale Gabe von Penicillin ist in allen Stadien die Therapie der Wahl. Resistenzen gegen Penicillin sind für Treponema pallidum bisher nicht bekannt.
Bei HIV-Infizierten ist in der Frühsyphilis derzeit Benzathinpenicillin 2,4 Mio. IE i.m. (z.B. je 1 Ampulle Pendysin® oder Tardocillin® zu je 1,2 Mio i.m. in jede Gesäßhälfte) in wöchentlichen Abständen über mindestens 2 Wochen (in der Spätsyphilis über mindestens 3 Wochen) die Therapie der Wahl. Bei unklarem Infektionszeitpunkt sollte die Lues stets wie eine Spätsyphilis behandelt werden.
Bei Penicillin-Unverträglichkeit werden Doxycyclin 2x 100 mg per os, Erythromycin 2 g/Tag per os (Generika) für mindestens 2 Wochen, Azithromycin oder Ceftriaxon (i.m., i.v.) empfohlen. Diese Alternativen sind abgesehen vom Ceftriaxon vermutlich weniger zuverlässig als die intramuskuläre Gabe von Penicillin. Resistenzen von Treponema pallidum gegen Makrolide sind bereits aufgetreten.
Neurolues
Eine Neurosyphilis wird ebenso wie eine Lues mit occulärer Beteiligung üblicherweise mit 3x 10 Mio. IE oder 6x 5 Mio. IE Penicillin G intravenös über 21 Tage behandelt. Bei Penicillin-Unverträglichkeit kann eine Neurosyphilis auch mit Ceftriaxon 2 g (Rocephin®) einmal täglich intravenös für ca. 10-21 Tage behandelt werden. Die deutschen Leitlinien empfehlen eine Initialdosis von 4 g Ceftriaxon.
Kreuzallergien (<10%) zwischen Penicillinen und Cephalosporinen sind möglich aber selten. Behandlungsalternativen sind Doxycyclin (z.B. Doxyhexal SF) 2x 100 mg/täglich oder Erythromycin (z.B. Erythrocin®) 4x 500 mg/täglich für mindestens 3 Wochen. Bei Makroliden ist allerdings eine Resistenzentwicklung möglich. Mitunter wird in spezialisierten Zentren trotz vermuteter Penicillin-Allergie ein kontrolliertes Penicillin-Hardening (Gewöhnung) unter stationären Bedingungen (Reanimationsbereitschaft) bis zur therapeutischen Volldosis durchgeführt.
Cortison vor Therapie
Zu Beginn einer Syphilisbehandlung sollte − unabhängig vom Stadium − die Jarisch-Herxheimer-Reaktion von einer Penicillinallergie abgegrenzt werden. Die Jarisch-Herxheimer-Reaktion wird in Abhängigkeit vom Stadium der Lues bei knapp 20% der Syphilis-Patienten innerhalb der ersten 48 Stunden nach der ers-ten Antibiotikagabe beobachtet. Durch die Freisetzung pyrogener, vasoaktiver Endotoxine infolge des raschen Zerfalls von Bakterien können Exantheme und grippeartige Symptome wie Schüttelfrost, Fieber, Gelenk- oder Muskelschmerzen auftreten.
Die Jarisch-Herxheimer-Reaktion kann durch eine einmalige Gabe von 1 mg/kg KG Prednisolon per os oder intravenös vor der ersten Antibiotika-Injektion verhindert oder zumindest in ihrer klinischen Ausprägung deutlich reduziert werden.
Kontrollen
Der Therapieerfolg wird durch klinische und serologische Kontrollen 3, 6, 12, 18 und 24 Monate nach Behandlungsende überprüft. Er zeigt sich zunächst durch das Abheilen klinischer Symptome und einen deutlichen Titerabfall der nicht treponemenspezifischen Aktivitätsparameter (Reduktion des VDRL mindestens zwei Titerstufen innerhalb von drei Monaten). Ein Wiederanstieg der zunächst abgefallenen Aktivitätsparameter kann eine behandlungsbedürftige Re-Infektion oder Reaktivierung bedeuten. Dies wird angenommen, wenn die serologischen Titer gegenüber dem Ausgangswert nach Therapieende um mehr als zwei Titerstufen ansteigen. Selbst bei HIV-Infizierten sollte nach erfolgter suffizienter Lues-Therapie spätestens nach zwei Jahren der IgM-Test nicht mehr reaktiv sein. Wenn der IgM-Test einmal nicht mehr reaktiv war, bedeutet eine erneute Reaktivität eine behandlungsbedürftige Re-Infektion oder Reaktivierung (s.o. Interpretation der Lues-Serologie).
Trotz Nachweis von Treponemenantikörpern besteht weder nach Ausheilung noch nach erfolgreicher Behandlung eine Immunität gegen die Syphilis, so dass eine erneute Ansteckung unmittelbar nach Absinken der Antibiotikaspiegel möglich ist.
FAQ: Was Sie schon immer wissen wollten und ...
Wie oft sollte man asymptomatische HIV-Infizierte auf Lues screenen?
Mindestens 1x/Jahr, bei Hochrisikopatienten quartalsweise.
Soll man bei V. a. einen Primäraffekt beim Abstrich für die PCR Sekret exprimieren?
Denkbar ist, dass Reizsekret eine höhere Erregerdichte aufweist als der einfache Abstrich, aber dazu gibt es keine Daten. Diese Frage spielt ohnehin höchst selten eine Rolle, die Lues-PCR ist eine kosten- und zeitaufwändige Methode und wird daher in der Praxis meist nicht eingesetzt. In der Regel wird nach klinischer Diagnose des Primäraffektes gleich behandelt.
Wann lohnt sich die Serologie bei einem Primäraffekt?
Immer, inklusive Verlaufskontrolle!
Sollte man bei Therapie einer Lues I Cortison geben?
Erregerzerfall ist Erregerzerfall. Wir geben immer einmalig Kortison vor Therapiebeginn.
Wie/wo kann man sich bei Lues II (nur Exanthem) anstecken?
Die Epidermis sitzt bei der LII satt voll mit Treponemen und eine Bakterämie verteilt diese im ganzen Körper der Betroffenen. Ich persönlich glaube solange meine eigene Hautbarriere intakt ist im alltäglichen Leben nicht ansteckungsgefährdet zu sein (Eigene Einschätzung, die nicht auf wissenschaftlichen klinischen Daten beruht.). Läsionen palpiere ich dennoch lieber mit Schutzhandschuhen.
Wann sollte man zur Liquorpunktion überweisen?
Bei allen Betroffenen mit neurologischen oder psychiatrischen Symptomen oder unklarem Infektionszeitpunkt sowie bei Patienten mit häufigen „Rezidiven“.
Ab wann ist der Patient nach Therapie einer Lues II nicht mehr ansteckend?
Nach der vollständigen Abheilung aller Primäreffloreszenzen oder bei asymptomatischen Patienten nach der zweiten Penicillin i. m. Gabe (Tag 8.) (Eigene Einschätzung, die nicht auf wissenschaftlichen klinischen Daten beruht.).
Wann sollte man Kontaktpersonen testen/behandeln?
Wenn intime Kontakte (auch Küssen oder Petting) stattgefunden haben. Der Nachweis einer Syphilis ist die Voraussetzung für eine Behandlung von Kontaktpersonen.
Wie soll man nach einem Abfall des VDRL um lediglich 1 Stufe nach 3 Monaten behandeln?
Aggressiv zuwarten.
Ist Küssen und Oralverkehr mit Syphilis-Patienten ansteckend?
Ja, wenn der Partner aktuell an einer Syphilis erkrankt ist.
Besteht beim Nachweis von Treponemen-Antikörpern eine Immunität gegen die Syphilis?
Nein.
Gibt es eine verfügbare Impfung?
Nein.









 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
