Update S3-Leitlinie nosokomiale Pneumonie
Die rund 100 Seiten umfassende aktualisierte der S3-Leitlinie „Epidemiologie, Diagnostik und Therapie erwachsener Patienten mit nosokomialer Pneumonie“ wurde von der DGP (Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin) federführend in Zusammenarbeit mit 11 weiteren Fachgesellschaften und Institutionen verfasst. Beteiligt war erstmals auch ein Vertreter einer Patienten-Selbsthilfegruppe.
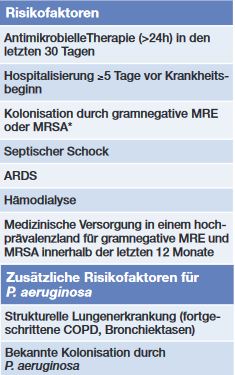
Tab. 1 Therapierelevante Risikofaktoren für multiresistente Erreger
Die
in der Regel aufwändige Literaturrecherche und Evidenzbewertung
wurde von einer professionellen
Methodologin durchgeführt, die
die Ergebnisse den Leitlinien-Autorinnen und -Autoren vorstellte.
Darauf basierend wurde das Update diskutiert und verabschiedet.
Finanziell gefördert wurde das Leitlinien-Update vom Innovationsfond
des Gemeinsamen Bundesausschusses (G-BA).
Die Expertinnen und Experten formulierten 26 Empfehlungen, bei denen jeweils der Evidenz- und Konsensgrad hinterlegt ist sowie zwei „Best Practice Statements“.
Definition
Die Definition der nosokomialen Pneumonie (HAP/hospital-acquired pneumonia) ist definiert als Lungenentzündung, die mehr als 48 Stunden nach der Aufnahme in einem Krankenhaus auftritt. Früher wurden auch noch Pneumonien, die innerhalb von drei Monaten nach der Entlassung auftraten, als nosokomial eingestuft.
Diagnostik
Die Diagnose wird klinisch gestellt: Neues, persistierendes oder progredientes Lungen-Infiltrat in Kombination mit zwei von drei Kriterien: Leukozyten >10.000 oder <4000/µl, Fieber >38,3 C, purulentes Sekret. Biomarker haben keine diagnostische Aussagekraft.
Blutkulturen zur Diagnose einer Sepsis mit extrapulmonalem Fokus sowie Kulturen aus tiefem Bronchialsekret sind obligat, wobei initial auch transbronchial gewonnenes Sekret ausreicht. Eine semiquantitative mikrobiologische Auswertung ist sinnvoll. Die Untersuchung auf Legionellen-Antigen im Urin ist optional, da die nosokomiale Legionellen-Pneumonie in Deutschland keine Rolle spielt. Nicht empfohlen wird der regelhafte Einsatz der Multiplex-PCR aufgrund der fehlenden Evidenz.
Neu in der Leitlinie ist die Empfehlung zur Untersuchung auf Influenza und SARS-CoV-2 in der Saison. Eine weitere virologische Diagnostik (z.B. RSV) wird außerhalb von lokalen Ausbrüchen nicht empfohlen.
Die Evidenz zum Nutzen der Aspergillus-Diagnostik anhand von Antigenen ist gering, dennoch war der Konsens für eine Empfehlung dieser Untersuchung stark und zwar bei Immunsuppression (z.B. Steroide, COPD usw.) mit erhöhtem Risiko für invasive Aspergillosen. Hier soll ein Antigentest (Galaktomannan, Grenzwert >=1,0) aus bronchoalveolärer Lavage durchgeführt werden.
Therapie
Im Hinblick auf die kalkulierte Antibiotika-Therapie unterscheidet man zunächst zwei Patientengruppen: Patienten mit bzw. ohne septischem Schock. Anschließend wird differenziert, ob ein Risiko für MRE (multiresistente Erreger) und/oder Pseudomonas aeruginosa besteht (Tab. 1). Neu bei den Risikofaktoren für letztere Gruppe sind das ARDS (Acute Respiratory Distress Syndrome) und die Dialyse sowie eine bis zu 30 Tage zurückliegende antibiotische Therapie (früher 90 Tage).
Bei Patienten ohne Schock und ohne Risikofaktoren dominieren die klassischen Erreger der ambulant erworbenen Pneumonie, aber ohne die atypischen Keime Chlamydien und Mykoplasmen. Hier empfiehlt die Leitlinie Aminopenicillin mit Betalaktamase-Inhibitor, Cephalosporine der Gruppe 3a oder Fluorchinolone. Für Patienten mit septischem Schock und ohne Risiko für MRE wird eine Therapie mit Meropenem empfohlen.
Liegt kein Schock, aber ein Risiko für MRE vor, empfiehlt die Leitlinie ein Betalaktam-Antibiotikum mit Pseudomonas-Wirkung (z.B. Piperacillin/Tazobactam), Cefepim oder Meropenem. Ceftazidim wird nicht mehr empfohlen.
Der septische Schock mit Risiko für MRE ist die einzige Indikation für eine empirische Kombinationstherapie. Empfohlen wird ein Betalaktam mit Pseudomonas-Wirkung zusammen mit einem Pseudomonas-wirksamen Fluorchinolon oder Tobramycin oder (neu) Fosfomycin – plus Linezolid oder Vancomycin bei MRSA-Verdacht. Außerhalb dieser Indikation ist die „double Gram-negative coverage“ nach Meinung der Leitlinienkommission eine Übertherapie. (Abb. 1)
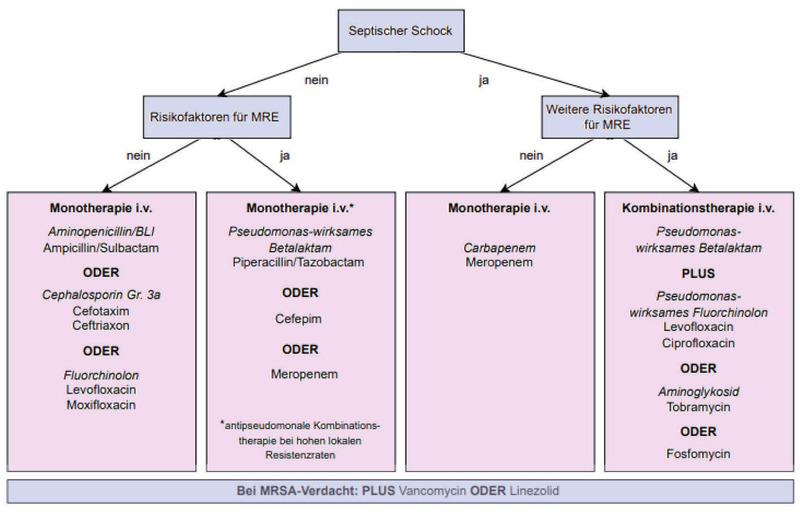
Abb. 1 Kalkulierte Antibakterielle Therapie der HAP
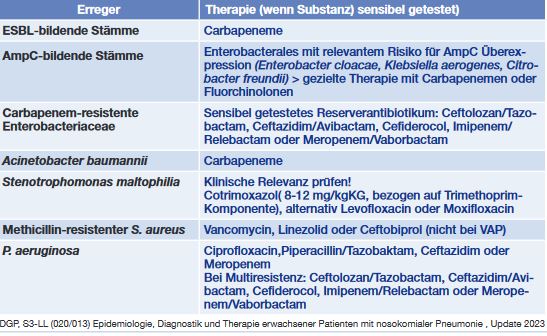
Tab. 2 Gezielte Therapie bei speziellen Erregern
Als Therapiedauer werden bei gutem Ansprechen sieben bis acht Tage empfohlen Bei gutem Ansprechen soll die Therapie deeskaliert werden, bei Nachweis eines relevanten Erregers soll die Therapie fokussiert werden. Für spezielle Situationen gibt es noch Empfehlungen zur prolongierten Infusion von Betalaktam-Antibiotika und für spezielle Problemkeime gesonderte Empfehlungen zur Antibiotika (Tab. 2).
Von der routinemäßigen zusätzlichen inhalativen Antibiotikatherapie wird ausdrücklich abgeraten. Nur bei multiresistenten gramnegativen Keimen, die Colistin und/oder Aminoglykosidempfindlich sind, sollte die inhalative Therapie mit geeigneten Verneblern erwogen werden. Hierzu gibt es als Anhang eine Anleitung.
Therapieversagen
Zeigt sich bei der Re-Evaluation zwei bis drei Tage nach Therapiebeginn keine Besserung, findet man in einem neuen Kapitel Vorschläge zum weiteren Vorgehen. An erster Stelle steht die Wiederholung bzw. Intensivierung der Diagnostik. Beim Nachweis von Herpes-Simplex mit einer hoher Viruslast in der bronchioalveolären Lavage, kann bei passendem klinischem Bild (Bildgebung, Ausschluss anderer Pathogene) eine Therapie mit Aciclovir erwogen werden.







 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
