Hiv-1 Serokonverterstudie
 Hepatitis-B-Infektion und -Impfung bei Menschen mit HIV in Deutschland, 1996-2019
Hepatitis-B-Infektion und -Impfung bei Menschen mit HIV in Deutschland, 1996-2019
Während die Inzidenz der meldepflichtigen HBV-Fälle in der Allgemeinbevölkerung in Deutschland im Jahr 2019 bei 0,01/100 Personenjahren lag, berichten Jansen et al. von einer Inzidenz von 3,2/100 Personenjahren unter Männern, die Sex mit Männern (MSM) haben, mit HIV leben und an der HIV-1 Serokonverter-Kohorte für den Zeitraum 2008-2012 teilnahmen. Eine Übersichtsarbeit über die Prävalenz von Hepatitis B, C und D in Deutschland berichtet eine HBsAg-Seroprävalenz von 0,3%-1,6% in der Allgemeinbevölkerung, während für Menschen, die mit HIV leben (PLWH), eine HBsAg-Seroprävalenz von 4,5% festgestellt wurde.
Ziel der Analyse ist es, die Prävalenz und Inzidenz von HBV-Koinfektion und die HBV-Impfquote bei PLWH in Deutschland zu bestimmen, um die Screening- und Präventionsstrategien bei Bedarf kontinuierlich anzupassen und den aktuellen Stand der globalen Ziele zur Eliminierung von Virushepatitis als Bedrohung der öffentlichen Gesundheit zu bewerten.
Methoden
Die Studienpopulation sind PLWH in Deutschland, die an der HIV-1-Serokonverterstudie teilnehmen. Dies ist eine bundesweite, multizentrische, prospektive Langzeitbeobachtungsstudie. Insgesamt 63 Studienzentren in ganz Deutschland rekrutieren Patient*innen mit einem bekannten oder zuverlässig geschätzten Datum der HIV-1-Serokonversion. In dieser Studienpopulation ist die Mehrheit der Teilnehmenden männlich, gab MSM-Kontakt als wahrscheinlichen HIV-Übertragungsweg an und lebt in Berlin. Die Teilnehmenden haben eine früh diagnostizierte HIV-Infektion, was bedeutet, dass sie tendenziell auch besser medizinisch betreut sind.
Grundlage für die Analyse sind die HBV Testergebnisse der im Rahmen der Studie entnommenen jährlichen Blutproben und entsprechende Angaben dazu aus dem jährlichen Studienfragebogen.
Der Analysezeitraum war vom 15. Juni 1996 bis zum 31. Dezember 2019. Die Analyse der HBV-Prävalenz, -Inzidenz, und -Impfung wurde in 4-Jahres-Zeiträumen für die Jahre 1996-1999, 2000-2003 und 2004-2007 durchgeführt, sowie in jährlichen Analysen für die Jahre 2008-2019, da die Studienpopulation zu Beginn der Kohortenstudie noch klein war.
Einschlusskriterien
Für diese Analyse wurden zusätzliche Einschlusskriterien zu den Kriterien der HIV-1-Serokonverterstudie angewandt. Für die Berechnung der HBV-Prävalenz musste mindestens ein HBV-Testeintrag – unabhängig vom Testergebnis – vorliegen. Für die Berechnung der HBV-Inzidenz mussten Teilnehmende bei Analysebeginn seronegativ sein und mindestens einen zusätzlichen HBV-Testeintrag, unabhängig vom Testergebnis, aufweisen.
Laboranalyse HBV
Von Beginn der Studie bis Juni 2012 wurden alle eingegangenen Plasmaproben zur Bestimmung des HBV-Infektionsstatus getestet. Zwischen Juli 2012 und Oktober 2016 wurde nur die letzte erhaltene Probe getestet. Bei Studienteilnehmenden, bei denen die letzte Probe positiv war oder die in ihrem Fragebogen zwischen Juli 2012 und Oktober 2016 ein positives HBV-Testergebnis angegeben hatten, wurden zusätzlich alle eingegangenen Proben getestet. Im Zeitraum 2017-2019 wurden keine zusätzlichen HBV-Labortests durchgeführt, jedoch sind die HBV-Testergebnisse aus dem Studienfragebogen in die Analyse eingeflossen.
Auf Grundlage der vom Labor und über den Fragebogen gemeldeten bzw. berichteten Testergebnisse wurden Teilnehmende mit negativen HBsAg-, aber positiven Anti-HBc-Testergebnissen als positiv für eine ausgeheilte HBV-Infektion eingestuft. Teilnehmende mit einem positiven HBsAg-Testergebnis galten als positiv für eine akute/chronische HBV-Infektion. Teilnehmende mit positiven Anti-HBs-Testergebnissen, bei negativen Anti-HBc- und HBsAg-Testergebnissen, wurden als HBV-geimpft betrachtet.
Anhand von Fragebogenangaben zum Datum und zur Anzahl der erhaltenen Impfdosen wurde ermittelt, ob die HBV-Impfung vor oder nach der HIV-Serokonversion durchgeführt wurde.
Statistische Analyse
Die HBV-Prävalenz und der Impfstatus wurden in 4-Jahres-Zeiträumen (1997-2007) oder pro Jahr (2008-2019) als der jeweilige Anteil der Teilnehmenden mit einer akuten/chronischen, ausgeheilten HBV-Infektion oder HBV-Impfung unter allen Studienteilnehmenden mit HBV-Testergebnissen für dieses Jahr/diesen Zeitraum berechnet. Da das tatsächliche Datum der HBV-Übertragung unbekannt ist, wurde für die HBV-Inzidenz angenommen, dass das Datum in der Mitte zwischen dem letzten negativen Testergebnis und dem ersten HBV-positiven Testergebnis liegt. Die zur Inzidenzberechnung beigetragene Personenzeit wird vom ersten negativen Testergebnis bis zum berechneten Datum der HBV-Infektion oder dem Datum des letzten negativen Testergebnisses berechnet. Die Inzidenzraten wurden pro 100 Personenjahre angegeben.
Ergebnisse

Abb. 1 Prävalenz akuter/chronischer oder ausgeheilter HBV-Infektionen und HBV-Impfung nach Zeitraum (1996-2019)
Bis zum 31. Dezember 2019 wurden insgesamt 3.479 Teilnehmende der HIV-1-Serokonverterstudie mit einem vorliegenden HBV-Testergebnis in diese Analyse eingeschlossen. Die mediane Beobachtungszeit der Teilnehmenden in der Studie betrug 4,3 Jahre (Spanne 0-21) mit insgesamt 14.830 Follow-up-Personenjahren. Im Median konnten 3 HBV-Testergebnisse je Teilnehmer*in analysiert werden (Spanne: 1-23).
Die Mehrheit der Teilnehmer*innen war männlich (95%, n=3.292) und gab MSM-Kontakt als wahrscheinlichen HIV-Übertragungsweg an (87%, n=3.020). Die meisten Teilnehmenden waren zum Zeitpunkt der HIV-Serokonversion 25-34 Jahre alt (44%, n=1.540), kamen aus Deutschland (84%, n=2.919) und wurde in Berlin rekrutiert (51%, n=1.764), gefolgt von 14% aus Nordrhein-Westfalen (n=481).
HBV-Prävalenz
Die kumulative Prävalenz von HBV, definiert als HBV-Positivität unabhängig von einer akuten/chronischen oder ausgeheilten Infektion, lag bei den 3.479 Studienteilnehmenden im Studienzeitraum von 1996 bis 2019 bei 30% (n=1.032; 95%-KI: 28 - 31).
Die Prävalenz ausgeheilter HBV-Infektionen ging kontinuierlich von 52% im Zeitraum 1996-1999 auf 16% im Jahr 2019 zurück (Abb. 1). Die Prävalenz akuter/chronischer HBV-Infektionen lag im Gesamtzeitraum bei 3,9% (95%-KI: 3,3 - 4,6) und sank ebenfalls von 4,1% (95%-KI: 2,0 - 8,5) im Zeitraum 1996-1999 auf 1,3% (95 %-KI: 0,6 - 2,8) im Jahr 2019. Pro Jahr/Zeitraum gerechnet, nahm die HBV-Infektionsprävalenz ab, wohingegen der Anteil der Teilnehmenden mit einer serologisch nachweisbaren HBV-Impfung zunahm. Im Gesamtzeitraum 1996-2019 war bei 54% (n=1.855; 95%-KI: 52 - 55) der Studienteilnehmenden eine HBV-Impfung indiziert. Der Anteil der HBV-geimpften Teilnehmenden stieg im Laufe der Zeit von 25% (95%-KI: 19 - 33) im Zeitraum 1996-1999 auf 69% (95%-KI: 65 - 73) im Jahr 2019. Der Anteil der Teilnehmenden mit HBV-negativen Testergebnissen stieg bis 2008 mit 24% (95%-KI: 22 - 27) an und sank dann wieder auf 14% (95%-KI: 11 - 17) im Jahr 2019.

Tab. 1 Ergebnisse der multivariablen Poisson-Regressionsanalyse zur Bewertung des Risikos von Geschlecht, Alter, HIV Transmissionsrisiko und Herkunftsregion als Faktoren, die mit der Prävalenz einer akuten/chronischen oder ausgeheilten HBV-Infektionen in Verbindung stehen
Mittels multivariabler Regressionsanalyse wurde das relative Risiko jemals eine HBV-Infektion (aktiv/chronisch oder ausgeheilt) zu haben im Vergleich zu einem HBV-negativen Status berechnet. Die Ergebnisse zeigten ein geringeres relatives Risiko für weibliche im Vergleich zu männlichen Studienteilnehmenden sowie für Studienteilnehmende, die jünger als 25 Jahre alt waren, im Vergleich zu den 25- bis 34-Jährigen (Tab. 1). Teilnehmenden, die 35 Jahre oder älter waren, hatten ein erhöhtes relatives Risiko, jemals eine HBV-Infektion zu haben. Im Vergleich zu Studienteilnehmenden, die als HIV-Transmission eine heterosexuelle Übertragung angaben, waren alle anderen angegebenen Risiken für eine HIV-Transmission (MSM, injizierender Drogenkonsum, berufliche Exposition und Herkunft aus einem Hochprävalenzland) mit einem erhöhten Risiko verbunden, jemals eine HBV-Infektion gehabt zu haben. Darüber hinaus wiesen Teilnehmende, die ein asiatisches Land als Herkunftsland angaben, ein höheres relatives Risiko für eine HBV-Infektion im Vergleich zu Teilnehmenden mit Herkunftsland Deutschland.
HBV-Inzidenz
Insgesamt konnten 565 von 3.479 Studienteilnehmende in Analyse der HBV-Inzidenz eingeschlossen werden, was einer Gesamtzahl von 2.287,5 Personenjahren entspricht. Für die übrigen Studienteilnehmenden lag entweder nur ein einziges HBV-Testergebnis vor oder sie waren bereits zu Studieneintritt HBV-positiv oder HBV-geimpft. Die für den Gesamtzeitraum von 1996-2019 berechnete HBV-Inzidenzrate betrug 2,2/100 Personenjahre (95%-KI: 1,7 - 2,9; 51 HBV-Infektionen). Die HBV-Inzidenzrate war im Zeitraum 2004-2007 mit 6,9/100 Personenjahre (95%-KI: 4,4 - 12; 20 HBV-Infektionen; 291 Personenjahre) am höchsten und ging in den folgenden Jahren zwar nicht kontinuierlich, jedoch auf deutlich niedrigere Inzidenzraten in den Jahren 2013-2015 zurück (Abb. 2). Es ist wichtig zu beachten, dass die Inzidenzraten hier auf wenigen Beobachtungen und HBV-Infektionen beruhen, mit zum Beispiel nur einer HBV-Infektion und 222 Personenjahren im Jahr 2015 oder zwei HBV-Infektionen und 135 Personenjahren im Jahr 2017. In den Jahren 2016, 2018 und 2019 wurden keine HBV-Infektionen beobachtet.
HBV-Impfstatus
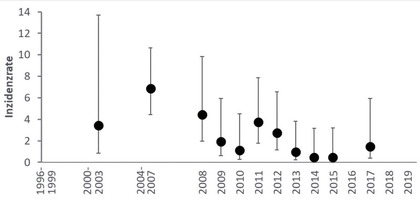
Abb. 2 HBV-Inzidenzrate pro 100 Personenjahre unter den eingeschlossenen Studienteilnehmern (n=565) nach Zeitraum/Jahr (1996-2019)
Der HBV-Impfstatus der Studienteilnehmenden für den jeweiligen Zeitraum ist in Abbildung 1 dargestellt. Zur weiteren Bestimmung des Impfstatus wurden zusätzliche Angaben des Studienfragebogens hinsichtlich der Anzahl der Impfstoffdosen und dem Datum der Impfung herangezogen. Laut Fragebogenangaben erhielten Teilnehmende mit entsprechenden Angaben dazu im median drei Impfstoffdosen (Spanne: 1-20 Dosen). Für insgesamt 1.135 Studienteilnehmende lagen Informationen zum Datum der Impfung vor, von denen 38% (95%-KI: 35-41; n=292) ihre erste gemeldete HBV-Impfung nach ihrer HIV-Infektion erhalten hatten.
Einfluss der HIV-Therapie auf die HBV-Infektion
Unter allen Studienteilnehmenden, die für eine HBV-Infektion empfänglich waren und in den Fragebögen über eine Behandlung mit Tenofovir berichteten (n=326), hatten drei Studienteilnehmer (1%) eine HBV-Infektion. Einer dieser drei Teilnehmer mit einer HBV-Infektion hatte zwei dokumentierte Testergebnisse, die auf eine HBV-Impfung hinwiesen. Bei weiteren sieben Studienteilnehmenden (2%) war für den Zeitraum zwischen zwei Besuchen eine HBV-Infektion und eine Tenofovir-einschließende Therapie berichtet. Die zeitliche Abfolge der Infektion und des Behandlungsbeginns kann daher nicht zuverlässig bestimmt werden.
Unter den Studienteilnehmenden, die für eine HBV-Infektion empfänglich waren und eine antiretrovirale HIV-Therapie mit Emtricitabin oder Lamivudin erhielten (n = 141), kam es bei drei Studienteilnehmenden (2%) während der Behandlung zu einer HBV-Infektion. Bei einer*m weiteren Teilnehmer*in (1%) lag der Zeitpunkt der HBV-Infektion und des HIV-Therapiebeginns zwischen zwei Testergebnissen, sprich auch hier lässt sich die zeitliche Abfolge nicht bestimmen.
Diskussion
Über den gesamten Studienzeitraum von 1996 bis 2019 betrachtet wurde eine hohe HBV-Prävalenz (3,7%) bei den Studienteilnehmenden beobachtet. Zum Vergleich: In der Allgemeinbevölkerung wurde in einem Scoping Review von Studien aus dem Zeitraum 1996-2016 eine HBV-Prävalenz von 0,3-1,6% ermittelt. Daraus ergibt sich eine 2,3- bis 12-fach erhöhte HBV-Prävalenz unter PLWH in dieser Studie.
Seit der Empfehlung der HBV-Impfung für Neugeborene im Jahr 1994 hat die Durchimpfungsrate stark zugenommen, was sich auch in den Ergebnissen dieser Analyse zeigt. Gleichzeitig könnte es auch ein Erfolg der Impfempfehlungen sein, welche Auffrischungsimpfungen auch für bestimmte Risikogruppen, wie beispielsweise MSM, vorsieht. Dafür spricht auch das Ergebnis, dass 38% der HBV-geimpften Teilnehmenden mit entsprechenden Angaben erst nach ihrer HIV-Diagnose geimpft wurden. Interessanterweise blieb der Anteil der Studienteilnehmenden ohne HBV-Impfung und mit HBV-negativen Testergebnissen im Laufe der Zeit relativ stabil. Unter der Annahme eines anhaltenden Risikoverhaltens, welches bereits zu einer HIV-Übertragung geführt hat und somit das Risiko einer HBV-Infektion birgt, lässt sich dies durch den Schutz der HIV-Behandlung vor einer HBV-Infektion erklären.
Eine Analyse der HBV-Inzidenz war vor allem aufgrund der geringen Anzahl HBV-empfänglicher Studienteilnehmender schwierig. Trotz des hier beobachteten Rückgangs ist die für den gesamten Beobachtungszeitraum von 1996-2019 berechnete Inzidenzrate von 2,2/100 Personenjahre hoch im Vergleich zur, basierend auf den HBV-Meldungen nach IfSG, berechneten Inzidenz von 0,01/100 Personenjahre in der Allgemeinbevölkerung für 2019.
Schlussfolgerung
Zusammenfassung
Die HBV-Prävalenz für akute/chronische oder ausgeheilte Infektionen sank bei Teilnehmenden der HIV-1 Serokonverter-Studie von jeweils 4,1% bzw. 45% im Zeitraum 1996-1999 auf 1,3% bzw. 16% im Jahr 2019. Gleichzeitig stieg die Zahl der HBV-geimpften Teilnehmenden von 25% im Zeitraum 1996-1999 auf 69% im Jahr 2019. Von den HBV-geimpften Teilnehmenden mit vorliegenden Fragebogenangaben (n=1.135) erhielten 38% ihre erste HBV-Impfung nach der HIV-Infektion. Die HBV-Inzidenzrate von 565 eingeschlossenen Teilnehmenden sank von 6,9 pro 100 Personenjahre im Zeitraum 2004-2007 auf 0,45 pro 100 Personenjahre im Jahr 2015.
Diese Analyse zeigt eine kontinuierlich abnehmende Prävalenz der akuten/chronischen und ausgeheilten HBV-Infektionen und bedingt auch der HBV-Inzidenz unter PLWH im Studienzeitraum von 1996 bis 2019. Gleichzeitig ist der Anteil der Teilnehmenden mit HBV-Impfung gestiegen und erreichte 2019 eine Impfrate von 69%. Dies zeigt den großen Erfolg der Impfbemühungen, welche deutlich sichtbar zu einem Schutz von Menschen mit erhöhtem Infektionsrisiko führen. Allerdings sind 2019 immer noch 14% der Teilnehmenden ungeimpft und damit empfänglich für HBV-Infektionen. Somit sollte auch weiterhin Menschen, mit einem erhöhten Risikoverhalten für eine HBV-Infektion, eine HBV-Impfung angeboten werden. Trotz der sinkenden HBV-Prävalenz sind sowohl die HBV-Prävalenz als auch die -Inzidenz in dieser Studienpopulation im Vergleich zur Allgemeinbevölkerung in Deutschland deutlich erhöht. Dies unterstreicht die Wichtigkeit des empfohlenen Screenings auf HBV bei HIV-Diagnose und, abhängig von dem individuellen Risikoverhalten, in regelmäßigen Abständen auch danach. Ähnliche Screening-Empfehlungen mit teilweise kürzeren Screening-Intervallen wurden auch für MSM ausgesprochen, die die PrEP nutzen. Darüber hinaus kann auch die Verteilung von Konsumutensilien an bestimmte Hochrisikogruppen, wie z.B. an Netzwerke von MSM, die stimulierende Drogen konsumieren, empfohlen werden. Dies sollte durch eine Test- und – falls positiv – Behandlungsstrategie zur Reduzierung von HBV-Infektionen unterstützt werden.
1Abteilung für Infektionsepidemiologie, Robert-Koch-Institut, Berlin, Deutschland
2Abteilung für Infektionskrankheiten, Robert Koch-Institut, Berlin, Deutschland
3MVZ Labor Krone GbR, Bad Salzuflen, Deutschland









 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
