F. Kirchhoff, C. Peter, K. Herkommer, München
Prostata-Erkrankungen
Benignes Prostatasyndrom (BPS) und Prostatakarzinom sind häufige Erkrankungen des alternden Mannes. Die Kenntnis von Krankheitsbild, Diagnostik und Therapie ist auch für die HIV-Praxis wichtig und zwar nicht nur für die Früherkennung, sondern auch um Patienten und Urologen als kompetenter Ansprechpartner zu unterstützen.
Benignes Prostatasyndrom
Das Benigne Prostatasyndrom (BPS) ist eine Miktionsstörung und beschreibt die Korrelation von Symptomen des unteren Harntraktes (lower urinary tract symptoms, LUTS) und einer Blasenauslassobstruktion (bladder outlet obstruc-tion, BOO) aufgrund einer Prostatavergrößerung. Der häufig verwendete Begriff der Benignen Prostatahyperplasie (BPH) hingegen kann als Diagnose nur nach histologischer Untersuchung von Prostatagewebe gestellt werden.
Epidemiologie

Abb. 1
Benignes Prostataadenom©AdobeStock
Die Prävalenz des BPS wurde bisher in keiner deutschlandweiten Studie untersucht. Laut einer repräsentativen Studie an Männern der Stadt Herne (Nordrhein-Westfalen) aus dem Jahr 2011 leidet rund jeder 3. Mann über 50 Jahre an LUTS.1 Aufgrund der Häufigkeit und der damit verbundenen Kosten für das Gesundheitssystem wird die Erkrankung als Volkskrankheit eingestuft.4
Die Entstehung der Erkrankung ist nicht final geklärt. Unter anderem werden hormonelle Veränderungen im Alter und deren proliferative Effekte auf die Prostata beschrieben. Zudem konnte ein Einfluss genetischer Faktoren sowie des Lebensstils bzw. des Vorliegen eines metabolischen Syndroms auf die Entstehung und Schwere der Erkrankung gezeigt werden.3
Pathophysiologie
Die Prostata ist eine Drüse mit einem Volumen von ca. 15 ml und sitzt direkt unterhalb der Harnblase. Ihr Sekret beinhaltet Enzyme zur Verflüssigung des Ejakulats und macht in etwa 15-30% des Ejakulatvolumens aus. Die Drüse besteht aus einer inneren, periurethralen Zone, welche von einer Übergangszone (Transitionalzone) umgeben ist. Zudem lassen sich eine periphere, anteriore und zentrale Zone abgrenzen.
Die Prostatahyperplasie von Bindegewebs-, Epithel- und glatten Muskelzellen betrifft vornehmlich die Transitionalzone der Prostata und führt einerseits zur Einengung/Kompression der Harnröhre, andererseits zu einer Veränderung der Reizempfindlichkeit der sensorischen Fasern am Blasenauslass. Diese damit einhergehenden Beschwerden können isoliert, aber auch als Mischbild vorliegen und werden gemeinhin als obstruktive bzw. irritative Miktionsbeschwerden definiert.
Obstruktive Miktionsbeschwerden entstehen durch die Einengung des Urethralumens und resultierend in einem erhöhten Auslasswiderstand der Harnblase. Typische Beschwerden sind ein verzögerter Miktionsbeginn, eine Harnstrahlabschwächung und/oder eine unvollständige Entleerung der Harnblase (Restharn). Im Extremfall ist eine adäquate Miktion nicht mehr möglich (Harnverhalt).
Irritative Miktionsbeschwerden hingegen beschreiben eine erhöhte Reizempfindlichkeit der Harnblase mit Einfluss auf den regulären Füll- und Entleerungszyklus. Diese Blasenspeicherstörung äußert sich in einem häufigen Harndrang mit geringen Miktionsmengen (Pollakisurie), vermehrtem nächtlichen Wasserlassen (Nykturie) und/oder einem plötzlichen (=imperativen) Harndrang, der nicht unterdrückt werden kann. Dies kann auch zu ungewolltem Urinabgang führen.
Diagnostik
Die Primärdiagnostik umfasst zunächst eine ausführliche Anamnese. Diese beinhaltet neben der Evaluation von obstruktiven und irritativen Miktionsbeschwerden auch die Aspekte Harninkontinenz, Trinkverhalten (Menge, Verteilung im Tagesverlauf), Lebensstil sowie eine Sexualanamnese. Da die aufgrund des BPS unphysiologischen Verhältnisse im Miktionsvorgang komplizierte Harnwegsinfekte (inklusive Prostatitis, Epididymitis, Orchitis und Pyelonephritis) bis hin zur Urosepsis bedingen können, sollten zurückliegende Infektereignisse im Rahmen der Anamnese ebenfalls erfragt werden. Zur weiteren Abklärung bei auffälliger Anamnese ist eine fachurologische Abklärung indiziert.
Nicht jede Prostatavergrößerung führt automatisch zu einem relevanten Leidensdruck für den Betroffenen. Eine objektive Abschätzung des Leidensdrucks sowie der Lebensqualität durch ein BPS ist essentiell und die Grundlage für die weitere Therapieplanung. Ein mögliches Tool hierzu ist der International Prostate Symptom Score (IPSS). Neben 7 Fragen zur Miktion enthält der IPSS eine Frage zur möglichen Beeinflussung der Lebensqualität durch die aktuellen Miktionverhältnisse. Der IPSS bietet neben der Erstevaluation und Festlegung des Schweregrades vor allem auch die Möglichkeit die Entwicklung der Symptome und die Symptomlast im Verlauf zu monitoren. Auch die Anwendung ergänzender, umfangreicherer Lebensqualitätsfragebögen ist sinnvoll.
Die körperliche Untersuchung sollte neben einer Untersuchung des äußeren Genitals sowie einer orientierenden neurologischen Beurteilung auch eine digital-rektale Untersuchung umfassen. Hierbei erfolgt eine Beurteilung der Prostata hinsichtlich Größe, suspekter Verhärtungen und Druckdolenz.
Im Hinblick auf eine Prostatakrebs-Früherkennung ist eine ergänzende Bestimmung des Prostataspezifischen Antigens (PSA) im Blut möglich. Neben Prostatakrebs können auch Infekte, Harnverhalte oder die vorherige digital-rektale Untersuchung zu einem erhöhten PSA-Wert führen. Grenzwertige oder auffällige Befunde sollten kurzfristig kontrolliert werden und erfordern im Falle einer Bestätigung eine weiterführende Abklärung. Differentialdiagnostisch können Infektionen oder (Mikro-)Hämaturie verursachende Pathologien (Urolithiasis, Urothelkarzinom...) mittels einer Urin-Analyse (Urin-Teststreifen, ggf. Urin-Sediment, ggf. Urinkultur) als Ursache der Symptome beurteilt werden.
Ergänzende Diagnostik:
- Transabdominelle Sonographie: Mittels transabdomineller Sonographie ist eine Beurteilung der Restharnmenge sowie des oberen Harntraktes (Ausschluss Harnstauungsnieren) möglich. Zudem kann eine Messung der Detrusordicke (äußere Muskelschicht der Harnblase) erfolgen.
- Transrektale Sonographie: Die transrektale Sonographie ermöglicht einen vollständigen Überblick über das Prostataparenchym und stellt eine exakte Methode zur Bestimmung des Prostatavolumens dar.
- Uroflowmetrie: Durch eine Harnstrahlmessung (Uroflowmetrie) wird die Flusskurve und maximale Flussgeschwindigkeit im Rahmen der Miktion quantifiziert. Anschließend erfolgt meist eine sonographische Restharnbestimmung.
Weitere Diagnostikmethoden im Rahmen der Differentialdiagnostik:
- Urethrozystoskopie bei Mikro-/Makrohämaturie zum Ausschluss eines Blasentumors oder bei Verdacht auf eine Harnröhrenstriktur oder Blasenhalsenge
- Urodynamische Untersuchung/Blasendruckmessung in unklaren Fällen oder zur differentialdiagnostischen Evaluation einer neurogenen Blasenentleerungsstörung
Stadieneinteilung
In Abhängigkeit der Untersuchungsbefunde ist neben der Quantifizierung der Miktionsbeschwerden/Symptomlast mittels IPSS auch eine Stadieneinteilung (nach Alken) möglich:
- Stadium I (Reizstadium): Miktionsbeschwerden, keine Restharnbildung
- Stadium II (Restharnstadium): (zunehmende) Miktionsbeschwerden, Restharnbildung von 50-150 ml
- Stadium III (Dekompensationsstadium): Restharn >150 ml, Harnverhalt, Überlaufblase, Harnstauungsnieren
Medikamentöse Therapie
Je nach Schweregrad der Symptome und Symptomlast ist mit dem Patienten das therapeutische Vorgehen zu diskutieren.
Bei geringgradigen Beschwerden ohne hohen Leidensdruck kann ein kontrolliertes Zuwarten mit Anpassung des Lebensstils (Gewichtsreduktion, vermehrte sportliche Aktivität, ...) erfolgen. Regelmäßige Verlaufskontrollen sind indiziert um eine Dekompensation frühzeitig zu erkennen.
Phytotherapeutika (Sägepalmenfrüchte, Kürbissamen, ...) stellen eine Therapieoption dar. Aufgrund einer nicht eindeutigen Datenlage wird in der Leitlinie für deren Anwendung jedoch bisher keine allgemeine Empfehlung ausgesprochen.2
Im Falle einer höhergradigen Symptomlast sollte zunächst eine medikamentöse Therapie empfohlen werden. 𝛼1-Adrenorezeptor-Antagonisten und Phosphodiesterase-5-Inhibitoren beeinflussen nicht das Prostatavolumen, bieten aber den Vorteil eines schnellen Wirkeintritts und eignen sich besonders zur Behandlung irritativer Beschwerden. 5𝛼-Reduktasehemmer sind zur Langzeitbehandlung geeignet, wirken allerdings nicht akut, sodass der Wirkeintritt frühestens nach 3-6 Monaten zu erwarten ist.
Ein vielversprechendes Konzept ist hier die Kombinationstherapie aus 𝛼1-Adrenorezeptor-Antagonisten und Phosphodiesterase-5-Inhibitoren (rascher Wirkeintritt und Wirkung als Langzeitbehandlung mit erwarteter Volumenreduktion).
Die am häufigsten angewendeten Substanzen im Überblick:
- 𝛼1-Adrenorezeptor-Antagonisten, kurz 𝛼-Blocker (z.B. Tamsulosin, Silodosin, ...):
- Wirkung: Relaxation der glatten Muskelzellen und somit Reduktion des Blasenauslasswiderstandes, vornehmlich Beeinflussung der irritativen Miktionsbeschwerden
- Langzeitanwendungen bisher ohne signifikanten Einfluss auf die Progressionsendpunkte Harnverhalt und Operationsrisiko
- Nebenwirkungen: u.a. Ejakulationsstörungen (retrograde Ejakulation, Abnahme des Ejakulationsvolumens), Schwindel, Hypotonie, ...
- Phosphodiesterase-5-Inhibitoren (Tadalafil in niedriger Dosierung mit 5 mg/Tag):
- Wirkung: vergleichbar mit 𝛼1-Adrenorezeptor-Antagonisten, zudem positiver Effekt auf die erektile Funktion
- Nebenwirkungen: u.a. Anschwellen der Nasenschleimhaut, Schwindel, Tachykardie, Kopfschmerzen, Exanthem, ...
- 5𝛼-Reduktasehemmer (z.B. Finasterid, Dutasterid, ...)
- Wirkung: Hemmung der Umwandlung von Testosteron in Dihydrotestosteron und somit Volumenreduktion (ca. 30%) der Prostata, volle Wirksamkeit nach ca. 1 Jahr, vornehmlich Beeinflussung der obstruktiven Miktionsbeschwerden
- Positiver Effekt auf die Progressionsendpunkte
- Nebenwirkungen: u.a. verminderte Libido, erektile Dysfunktion, Abnahme des Ejakulationsvolumens
In speziellen Indikationen ist auch die Anwendung von Muskarinrezeptor-Antagonisten und ß3-Agonisten zugelassen.
Operative Therapie
Versagt die medikamentöse Therapie oder liegen Komplikationen vor ist ein operatives/interventionelles Vorgehen zu diskutieren. Zu möglichen Komplikationen, die eine absolute Operationsindikation darstellen, zählen rezidivierende Harnverhalte, rezidivierende Infektionen (Blase, Prostata, (Neben-)Hoden, Samenwege), rezidivierende Blutungen aus Prostatagefäßen, die Bildung von Blasensteinen oder Blasenpseudodivertikeln sowie eine Beteiligung des oberen Harntraktes (Harnstauungsnieren).
Das Ziel einer operativen Intervention ist eine Vergrößerung des Urethralumens. Eine Totalentfernung der Prostata erfolgt nicht.
Nach heutiger Datenlage stehen in Abhängigkeit der Drüsengröße verschiedene operative Techniken zur Verfügung. Am häufigsten werden transurethrale Verfahren angewendet. Bei diesen endoskopischen Eingriffen erfolgt ausgehend von der prostatischen Harnröhre die Entfernung von Prostatagewebe. Die Operationen reichen von der Resektionen periurethraler Drüsenabschnitte bei kleineren Drüsen (transurethralen Resektion der Prostata, TURP) bis zur lasergestützten Enukleation der Prostata bei größeren Adenomen (bspw. Holmium-Laser-Enukleation der Prostata, HoLEP).
Gerade durch den Einsatz von moderner Lasertechnik haben Schnittoperationen, welche bisher bei sehr großen Prostatavolumina angewendet wurden, an Bedeutung verloren. Dennoch stellen Enukleationen der Prostata durch eine offene oder roboter-assistierte, minimalinvasive Operation weiterhin eine Therapieoption dar. Hierbei wird das proliferierte Gewebe unter Erhaltung der peripheren Zone der Prostata sowie der Prostatakapsel entfernt. Insbesondere bei begleitenden interventionsbedürftigen Veränderungen (z.B. große Blasendivertikel) ist dieses Vorgehen zu diskutieren.
Komplikationen der transurethralen und schnittoperativen Eingriffe sind Blutungen, Nachblutungen, Infektionen und im Verlauf die Entwicklung von narbigen Stenosen. Nicht signifikant beeinträchtigt werden in der Regel Kontinenz und erektile Funktion.
Zudem kann durch das interventionell-radiologische Verfahren der Prostata-Arterien-Embolisation eine Reduktion des Prostatavolumens erzielt werden. Ein signifikant schwächerer Effekt auf die Miktionssymptomatik im Vergleich zu transurethralen Eingriffen bei jedoch geringerer Invasivität konnte gezeigt werden.
1 Berges R, Oelke M (2011) Age-stratified normal values for prostate volume, PSA, maximum urinary flow rate, IPSS, and other LUTS/BPH indicators in the German male community-dwelling population aged 50 years or older. World J Urol 29:171-178
2 Deutsche Gesellschaft FüR Urologie Arbeitskreis Benignes Prostatasyndrom (2023) S2e-Leitlinie Diagnostik und Therapie des Benignen Prostatasyndroms (BPS).
3 Gacci M, Corona G, Vignozzi L et al. (2015) Metabolic syndrome and benign prostatic enlargement: a systematic review and meta-analysis. BJU Int 115:24-31
4 Vuichoud C, Loughlin KR (2015) Benign prostatic hyperplasia: epidemiology, economics and evaluation. Can J Urol 22 Suppl 1:1-6
Prostatakarzinom –
Früherkennung und Diagnostik
Epidemiologie
In Deutschland treten jährlich ca. 65.000 Neuerkrankungen eines Prostatakarzinoms auf, dies entspricht einer altersstandardisierten Inzidenz von 99,1 pro 100.000 Einwohner und in etwa einem Viertel aller Tumorerkrankungen des Mannes (Stand 2018). Das mittlere Erkrankungsalter liegt bei 71 Jahren (Stand 2018).2
Im europäischen Vergleich ist ein deutliches Nord-Süd-Gefälle der Inzidenzraten zugunsten südlicher Länder auffällig (Schweden: 175,2/100.000, Griechenland: 34,2/100.0008), global betrachtet liegt ein signifikantes Ost-West-Gefälle zugunsten des asiatischen Raumes vor.
Risikofaktoren
Für die Entstehung eines Prostatakarzinoms sind mehrere Risikofaktoren beschrieben.
Alter
Das Lebensalter stellt den größten Risikofaktor des Prostatakarzinoms dar. Die Mehrheit der Erkrankungen tritt ab dem 50. Lebensjahr auf. Während das Erkrankungsrisiko innerhalb der nächsten 10 Lebensjahre im Alter von 35 Jahren bei unter 0,1% liegt, besteht für einen 75-jährigen Mann ein Risiko von 6%.2
Familiäre Disposition
Ein erhöhtes Erkrankungsrisiko bei positiver Familienanamnese ist belegt. Das Risiko einer Prostatakrebs-Erkrankung für erstgradige Angehörige ist um das 2,5-fache erhöht, wenn der Vater oder Bruder erkrankt ist.11, 17 Bei gehäuften Erkrankungsfällen oder einem jungen Erkrankungsalter der erstgradigen Angehörigen kann das Risiko auf das bis zu 10-fache ansteigen.
Auch monogene Veränderungen haben Einfluss auf das Erkrankungsrisiko. Beispielsweise ist für eine Mutation im Breast-Cancer-2 (BRCA2)-Gen eine höhere Inzidenz und Aggressivität sowie ein niedrigeres Erkrankungsalter nachgewiesen.
Eine humangenetische Beratung kann bei folgenden Kriterien erwogen werden: metastasiertes Prostatakarzinom, Prostatakarzinom mit hoher Risikokonstellation und Angehöriger mit der Diagnose eines Prostatakarzinoms im Alter <60 Jahren, mehrere Angehörige mit der Diagnose eines Prostatakarzinoms im Alter <60 Jahren, Prostatakarzinom-assoziierter Todesfall eines Angehörigen, Familienanamnese mit Hochrisiko-Keimbahnmutation oder mehreren Tumorerkrankungen.1
Ethnische Einflüsse
Für Männer afrikanischer Abstammung ist ein erhöhtes Erkrankungsrisiko beschrieben.9
Ernährung und sozioökonomische Faktoren
Unterschiedliche Ernährungsgewohnheiten sowie sozioökonomische Unterschiede beeinflussen ebenfalls das
Erkrankungs-Risiko.10 So treten im asiatischen Raum im Vergleich zu westlichen Ländern signifikant weniger
Erkrankungen auf. Dieser Unterschied fällt hingegen für Asiaten, die in den USA aufwachsen und leben,
geringer
aus.4
Eine protektive Wirkung von Phytoöstrogenen (Soja) und Lycopin (u.a. in Tomaten) ist ebenfalls beschrieben.7, 14
Einfluss inflammatorischer Prozesse
Die Pathogenese des Prostatakarzinoms wird in eine beginnende, nichtandrogen-sensitive und eine androgen-sensitive Phase unterteilt.
In der nichtandrogen-sensitiven Phase spielen neben genetischen Mutationen und epigenetischen Faktoren auch chronische Entzündungsprozesse eine Rolle. So ist ein erhöhtes Erkrankungsrisiko nach sexuell übertragbaren Erkrankungen (1,5-fach) und Prostatitiden (1,6-fach) beschrieben.5, 6
Prävention
Zur Krankheitsprävention sind wie bei allen Krebserkrankungen allgemeine Maßnahmen wie körperliche Aktivität, das Anstreben eines gesunden Körpergewichts, gemäßigter Alkoholkonsum sowie eine ausgewogene, vornehmlich vegetabile Ernährung empfohlen.
Sichere Evidenz für spezifische Präventionsmaßnahmen oder eine medikamentöse Prävention liegt nicht vor.
Früherkennung
Grundsätzlich ist das Prostatakarzinom eine Tumorerkrankung mit einem langsamen Wachstum. Kurative Therapieansätze sind im lokal begrenzten Stadium möglich.
Die Früherkennung zielt auf die Detektion von asymptomatischen Prostatakarzinomen bei Männern mit einer Lebenserwartung von mindestens 10 Jahren ab. In Deutschland umfasst die gesetzliche Prostatakarzinom-Früherkennung ab dem 45. Lebensjahr neben einem Anamnesegespräch die jährliche Untersuchung der äußeren Geschlechtsorgane inklusive Tastuntersuchung der Prostata und der Lymphknoten. Hochrisiko-Patienten (z.B. positive Familienanamnese, BRCA-Mutation) wird die Früherkennungsuntersuchung ab dem 40. Lebensjahr angeboten.
Digital-rektale Untersuchung
Ein Großteil der Prostatakarzinome entstehen in der peripheren Zone. Durch eine digital-rektale Tastuntersuchung (DRU) können mögliche suspekte Verhärtungen eines Teils der peripheren Zone der Prostata beurteilt werden.
Prostataspezifisches Antigen
Das prostataspezifische Antigen (PSA) ist ein in der Prostata gebildetes Enzym, welches der Verdünnung des Ejakulates dient. Beim Vorliegen eines Prostatakarzinoms kann der PSA-Wert im Blut erhöht sein. Vor einer PSA-Bestimmung im Rahmen der Früherkennung ist eine Diskussion mit dem Mann sowohl über den möglichen Nutzen als auch über mögliche Risiken im Sinne einer Überdiagnostik notwendig. Die europäische Leitlinie empfiehlt eine PSA-gestützte Früherkennung nach entsprechender Aufklärung für Männer mit erhöhtem Erkrankungsrisiko (ab dem 50. Lebensjahr, ab dem 45. Lebensjahr mit positiver Familienanamnese bzw. mit afrikanischer Abstammung oder ab dem 40. Lebensjahr mit vorliegender BRCA2-Mutation).1
Die PSA-Bestimmung ist bisher (Stand Oktober 2023) kein Bestandteil der gesetzlichen Prostatakarzinom-Früherkennung in Deutschland und somit keine Leistung der gesetzlichen Krankenkassen, allerdings soll auch gemäß der deutschen S3-Leitlinie Männern, die nach einer entsprechenden Aufklärung eine Früherkennungsuntersuchung wünschen, eine PSA-Bestimmung angeboten werden.13
Ein erhöhter PSA-Wert, welcher nicht durch den bisherigen Verlauf erklärt ist, bedarf stets einer Kontrollbestimmung zur Bestätigung. Mögliche passagere Einflussfaktoren auf die Höhe des PSA-Wertes sind:
- Technische Faktoren (Probenlagerung, Probentransport)
- Harnverhalt
- Akute Prostatitis
- Vorherige Manipulationen (beispielsweise durch DRU, Blasenkatheter-Einlage, Koloskopie)
Signifikante Einflüsse durch Ejakulationen konnten bisher nicht zweifelsfrei belegt werden. Dies gilt ebenso für Aktivitäten wie Fahrradfahren.
Die Höhe des PSA-Wertes ist auch abhängig vom Prostatavolumen. Zur weiteren Differenzierung ist zudem eine Bestimmung des freien PSA möglich. Das Risiko für ein klinisch relevantes Prostatakarzinom ist bei Männern mit einem Quotienten (freier PSA/Gesamt-PSA) von > 0,24 geringer.3
Verlaufsbestimmungen sollen in Abhängigkeit des PSA-Ausgangswertes und des Patientenalters erfolgen1:
- alle 2 Jahre
- PSA > 1 ng/ml ab 40 Jahren
- PSA > 2 ng/ml ab 60 Jahren
- alle 8 Jahre bei Männern unterhalb der genannten Grenzwerte und mit negativer Familienanamnese
In der deutschen S3-Leitlinie wird eine weitere PSA-gestützte Früherkennung für Männer ab 70 Jahren bei einem PSA-Wert < 1 ng/ml nicht empfohlen.13
Ergänzende, nicht-invasive Diagnostik
Durch die Durchführung einer multiparametrischen Magentresonanztomografie (mpMRT) der Prostata ist bei erhöhtem/ansteigendem PSA-Wert und/oder suspekter Tastuntersuchung eine genauere Differenzierung und Lokalisation möglich. Daher ist eine mpMRT der Prostata vor Planung einer invasiven Diagnostik empfohlen,1
Anhand eines standardisierten Klassifikationssystems möglicher Tumorherde (Prostate Imaging Reporting and Data System, PI-RADS) kann eine Risikoeinteilung für das Vorliegen eines Prostatakarzinoms erfolgen:
- PI-RADS 1: höchstwahrscheinlich gutartig
- PI-RADS 2: wahrscheinlich gutartig
- PI-RADS 3: unklarer Befund
- PI-RADS 4: wahrscheinlich bösartig
- PI-RADS 5: höchstwahrscheinlich bösartig
Eine hohe Sensitivität in der Karzinom-Detektion (>90%) wird insbesondere bei stärkerer Entdifferenzierung und Tumorherden >1 cm erreicht.12 Der Einsatz als primäre Früherkennungsmaßnahme ist nicht empfohlen. Die Kosten eines mpMRTs der Prostata werden durch die gesetzlichen Krankenkassen bisher nicht übernommen.
Prostatastanzbiopsie
Auffällige Untersuchungsbefunde (DRU, PSA-Wert und/oder mpMRT der Prostata) geben lediglich einen Anhaltspunkt für
das Vorliegen eines Prostatakarzinoms. Zur endgültigen Diagnosestellung ist eine invasive
Diagnostik mit
Gewebeentnahme zur histopathologischen Begutachtung indiziert.
Indikationskriterien zur invasiven Diagnostik gemäß der S3-Leitlinie
- PSA-Wert von ≥ 4 ng/ml (bestätigter Wert unter Berücksichtigung von Einflussfaktoren) oder
- Auffällige PSA-Dynamik (im gleichen Messungsverfahren) oder
- Karzinomsuspekter Tastbefund in der digital-rektalen Untersuchung
Bei einem mpMRT-Befund mit PI-RADS >3 ist in Zusammenschau mit der klinischen Untersuchung und dem PSA-Wert ebenfalls eine Prostatastanzbiopsie empfohlen.
Systematische Biopsie vs. Fusionsbiopsie
Die Prostatastanzbiopsie wird unter bildgebender Kontrolle mittels Sonographie durchgeführt.
Im Rahmen der systematischen Stanzbiopsie erfolgt eine Entnahme von mindestens 10 bis 12 Gewebezylindern (5-6 je Seite). Hierbei soll die Prostata nach einem festgelegten Schema in unterschiedlichen Lokalisationen (Basis, Mitteldrüse, Apex, jeweils medial und lateral) systematisch biopsiert werden.13
Sind in der mpMRT der Prostata suspekte oder unklare Läsionen beschrieben, ist eine zusätzliche gezielte Probenentnahme empfohlen. Hierfür werden die Bilddaten aus transrektaler Sonographie und mpMRT zusammengelegt (Fusionsbiopsie). Durch eine alleinige Fusionsbiopsie können ca. 5% der klinisch relevanten Prostatakarzinom übersehen werden.16 Daher wird weiterhin eine Kombination aus systematischer Prostatastanzbiopsie und Fusionsbiopsie empfohlen.
Transrektal vs. transperineal
Die Probenentnahme kann mittels transrektaler oder transperinealer Stanzbiopsie erfolgen. Beide Verfahren sind etabliert und können unter Lokalanästhesie durchgeführt werden.
Eine antibiotische Prophylaxe ist bei beiden Ansätzen empfohlen. Mögliche Komplikationen sind Infektionen
(Prostatitis, Harnwegsinfekt, bis hin zur Urosepsis), Blutungen und ein akuter Harnverhalt. Der transperineale Ansatz
wird aufgrund eines geringeren Infektrisikos vermehrt empfohlen.1, 15
Histopathologische Befundung
Anhand des gewonnen Probenmaterials kann die Diagnose eines Prostatakarzinoms gestellt und die Aggressivität beurteilt werden. In Abhängigkeit der Entdifferenzierung der Drüsenmorphologie der Prostata erfolgt die Festlegung des Gleason-Scores. Vermehrt wird eine Graduierung gemäß der Nomenklatur der International Society of Urological Pathology (ISUP) angegeben.
1 EAU Guidelines Office, Arnhem, the Netherlands. EAU guidelines on Prostate Cancer: update 2023. Edn. Presented at the EAU Annual Congress Milan 2023, 2023, ISBN 978-94-92671-19-6.
2 Robert Koch-Institut (RKI), Zentrum für Krebsregisterdaten und Gesellschaft der epidemiologischer Krebsregister in Deutschland (GEKID), Krebs in Deutschland für 2017/2018. 13th ed. 2021, Berlin. https://www.krebsdaten.de/Krebs/DE/Content/Publikationen/Krebs_in_Deutschland/kid_2021/krebs_in_deutschland_2021.pdf?__blob=publicationFile (Letzter Zugriff: 19.09.2023).
3 Catalona WJ, Partin AW, Slawin KM et al. (1998) Use of the percentage of free prostate-specific antigen to enhance differentiation of prostate cancer from benign prostatic disease: a prospective multicenter clinical trial. Jama 279:1542-1547
4 Cook LS, Goldoft M, Schwartz SM et al. (1999) Incidence of adenocarcinoma of the prostate in Asian immigrants to the United States and their descendants. J Urol 161:152-155
5 Dennis LK, Dawson DV (2002) Meta-analysis of measures of sexual activity and prostate cancer. Epidemiology 13:72-79
6 Dennis LK, Lynch CF, Torner JC (2002) Epidemiologic association between prostatitis and prostate cancer. Urology 60:78-83
7 Etminan M, Takkouche B, Caamaño-Isorna F (2004) The role of tomato products and lycopene in the prevention of prostate cancer: a meta-analysis of observational studies. Cancer Epidemiol Biomarkers Prev 13:340-345
8 Ferlay J, Steliarova-Foucher E, Lortet-Tieulent J et al. (2013) Cancer incidence and mortality patterns in Europe: estimates for 40 countries in 2012. Eur J Cancer 49:1374-1403
9 Haas GP, Delongchamps N, Brawley OW et al. (2008) The worldwide epidemiology of prostate cancer: perspectives from autopsy studies. Can J Urol 15:3866-3871
10 Hebert JR, Hurley TG, Olendzki BC et al. (1998) Nutritional and socioeconomic factors in relation to prostate cancer mortality: a cross-national study. J Natl Cancer Inst 90:1637-1647
11 Johns LE, Houlston RS (2003) A systematic review and meta-analysis of familial prostate cancer risk. BJU Int 91:789-794
12 Johnson DC, Raman SS, Mirak SA et al. (2019) Detection of Individual Prostate Cancer Foci via Multiparametric Magnetic Resonance Imaging. Eur Urol 75:712-720
13 Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft Deutsche Krebshilfe Awmf) (2021) S3-Leitlinie Prostatakarzinom, Langversion 6.2. In: AWMF-Registrierungsnummer 043/022OL.
14 Ozasa K, Nakao M, Watanabe Y et al. (2004) Serum phytoestrogens and prostate cancer risk in a nested case-control study among Japanese men. Cancer Sci 95:65-71
15 Pradere B, Veeratterapillay R, Dimitropoulos K et al. (2021) Nonantibiotic Strategies for the Prevention of Infectious Complications following Prostate Biopsy: A Systematic Review and Meta-Analysis. J Urol 205:653-663
16 Rouvière O, Puech P, Renard-Penna R et al. (2019) Use of prostate systematic and targeted biopsy on the basis of multiparametric MRI in biopsy-naive patients (MRI-FIRST): a prospective, multicentre, paired diagnostic study. Lancet Oncol 20:100-109
17 Zeegers MP, Jellema A, Ostrer H (2003) Empiric risk of prostate carcinoma for relatives of patients with prostate carcinoma: a meta-analysis. Cancer 97:1894-1903
Therapie des lokal begrenzten
Prostatakarzinoms
Stadieneinteilung
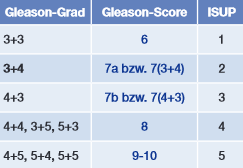
Tab. 1
Bei histopathologischer Sicherung eines Prostatakarzinoms kann anhand des Gewebes der Prostatastanzbiopsie die Tumoraggressivität beurteilt werden. In Abhängigkeit der Entdifferenzierung der Drüsenmorphologie der Prostata erfolgt eine Graduierung gemäß des Gleason-Grades von 3 (mäßige Entdifferenzierung) bis 5 (vollständige Entdifferenzierung). Der Gleason-Score wird bei der Prostatastanzbiopsie aus dem am häufigsten vorliegenden und dem am stärksten entdifferenzierten Gleason-Grad errechnet. Heutzutage wird meist eine Graduierung gemäß der Nomenklatur der International Society of Urological Pathology (ISUP) angegeben.
Zudem ist eine klinische Stadieneinteilung gemäß der TNM-Klassifikation der Union Internationale Contre le Cancer (UICC) empfohlen. Grundsätzlich werden hierbei lokal begrenzte (cT1/2 cN0 cM0), lokal fortgeschrittene (cT3/4 cN0 cM0) und metastasierte Erkrankungen (cN1 + cM1) unterschieden.
Das lokal begrenzte Prostatakarzinom wird gemäß der Risikoklassifizierung nach D’Amico in low, intermediate und high risk unterteilt2: siehe Tabelle 2.
Staging

Tab. 2
In Abhängigkeit der Risikoklassifizierung ist die Durchführung einer Stagingbildgebung vor einer Therapieentscheidung zu diskutieren. Bei low-risk Karzinomen ist keine Staginguntersuchung notwendig. Für intermediate-risk Karzinome liegt keine eindeutige Evidenz vor, ein radiologisches Staging muss individuell diskutiert werden. Patienten mit high-risk Karzinomen wird eine Stagingbildgebung empfohlen.1
Ein konventionelles Staging umfasst eine Schnittbildgebung des Abdomens und Beckens sowie eine Skelettszintigraphie.
Bei high-risk Karzinomen ist ein Staging mittels einer prostataspezifischen Membranantigen-gestützten Positronen-Emissions-Tomographie sowie Computertomographie (PSMA-PET-CT) empfohlen.4 Im Vergleich zum konventionellen Staging kann durch ein PSMA-PET-CT eine höhere Genauigkeit in der Detektion von Metastasen erzielt werden. Aufgrund fehlender prospektiver Studiendaten bezüglich der Therapiesequenz nach erfolgtem, präziserem Staging mittels PSMA-PET-CT ist eine regelrechte Anwendung für alle Risikoklassen kritisch zu diskutieren. Aktuell ist ein PSMA-PET-CT als Primärstaging keine Regelleistung der gesetzlichen Krankenkassen.
Therapiekonzepte des lokal begrenzten Prostatakarzinoms
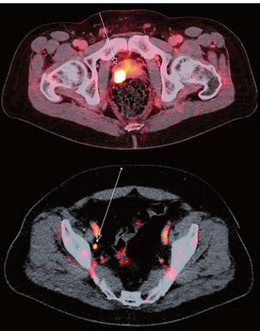
Abb. 2 PSMA-PET-CTs mit vermehrter PSMA-Expression in der Prostata (oben) und einem suspekten Lymphknoten (unten)©Urologische Klinik und Poliklinik, Klinikum rechts der Isar, F. Kirchhoff
Bei Diagnose eines lokal begrenzten Prostatakarzinoms stehen als Therapieoptionen sowohl eine aktive Überwachung (Active Surveillance) als auch eine Operation mittels radikaler Prostatektomie oder Strahlen- bzw. Brachytherapie zur Verfügung. Eine ausführliche Aufklärung über die Vor- und Nachteile der jeweiligen Option ist für die Entscheidungsfindung wichtig, um durch shared decision-making eine Therapieentscheidung mit dem Patienten zu treffen.
Active Surveillance
Neben aktiver Therapieverfahren soll auch die Durchführung einer aktiven Überwachung (Active Surveillance) diskutiert werden. Hierbei sind insbesondere das Patientenalter und Komorbiditäten zu berücksichtigen.
Bedingungen für eine Active Surveillance sind:
- PSA ≤10 ng/ml
- Gleason-Score 6
- max. cT2a
- Tumornachweis in ≤2 Stanzen (bei Entnahme von mind. 10-12 Stanzbiopsien)
- ≤50% Tumoranteil je Stanze
Wird eine Active Surveillance festgelegt, ist eine engmaschige, urologische Anbindung indiziert. Zum einen umfassen die Verlaufskontrollen eine PSA-Bestimmung und digital-rektale Untersuchung (für 2 Jahre vierteljährlich, bei stabilem Verlauf halbjährlich). Zum anderen sind erneute Prostatastanzbiopsien im Verlauf zur Evaluation eines Tumorprogresses notwendig.
Im Falle einer progredienten Erkrankung (PSA-Anstieg auf > 10 ng/ml, PSA-Verdopplungszeit unter 3 Jahren, histologischer Progress) ist eine Beendigung der Active Surveillance und Einleitung eines aktiven Therapieverfahrens empfohlen.5
Radikale Prostatektomie
Lassen die Tumorcharakteristika eine Active Surveillance nicht zu oder wünscht der Patient ein aktives Therapieverfahren stellt die radikale Prostatektomie eine führende, kurative Behandlungsoption dar. Eine Operation ist in allen Risikogruppen des lokal begrenzten Prostatakarzinoms möglich. Bei der radikalen Prostatektomie erfolgt eine vollständige Entfernung der Prostata sowie der Samenblasen mit anschließender Anastomosierung von Harnblase und Harnröhre. Je nach Risikoklassifizierung ist zudem eine pelvine Lymphadenektomie unterschiedlichen Ausmaßes empfohlen. Bei low-risk Karzinomen kann hierauf verzichtet werden.6
Für eine Erhaltung der Funktionalität (Kontinenz und erektile Funktion) ist eine Schonung des äußeren Blasenschließmuskels und des periprostatischen Gefäß-Nerven-Bündels erstrebenswert. Um eine maximal mögliche Nervschonung bei gleichzeitig onkologisch sicherer Entfernung zu erreichen, wird in manchen Zentren intraoperativ eine Schnellschnittdiagnostik der Resektionsränder des Präparates durchgeführt.
Die Durchführung einer radikalen Prostatektomie ist sowohl offen-chirurgisch als auch roboterassistiert-
laparoskopisch möglich. Potentielle OP-Komplikationen sind u.a. Nachblutungen, Entwicklung einer Lymphozele, Verletzung
von umliegenden Organen (Rektum, Harnleiter, Blase) und die verzögerte Abheilung der Anastomose zwischen Harnblase und
Harnröhre.
Die funktionellen Ergebnisse nach erfolgter Operation sind von der Tumorausdehnung und der möglichen Nervschonung abhängig. Die Kontinenz lässt sich durch regelmäßige Beckenbodengymnastik positiv beeinflussen. Eine höhergradige Inkontinenz besteht in bis zu 15% der Fälle auch 2 Jahre nach der Operation. Zum gleichen Zeitpunkt wird auch eine erektile Dysfunktion von 87% der Patienten beschrieben.7 Durch medikamentöse Unterstützung bzw. Verwendung von Hilfsmitteln ist eine Verbesserung der erektilen Funktion sowie der Durchführung von Geschlechtsverkehr möglich. Aufgrund der Durchtrennung der Samenleiter sowie der Entfernung der Prostata und der Samenblasen ist eine Ejakulation stets nicht mehr möglich, die Orgasmus-Funktion bleibt hingegen erhalten.
Durch eine radikale Prostatektomie kann eine Progression der Erkrankung mit Bildung von Fernmetastasen im Vergleich
zur Active Surveillance signifikant gesenkt werden.3 Die onkologische Nachsorge erfolgt mittels
PSA-Bestimmung. Eine erste Kontrolle sollte innerhalb von 12 Wochen, jedoch nicht früher als 6-8 Wochen nach
radikaler Prostatektomie erfolgen. Im Falle eines lokalen Rezidivs nach primärer Operation besteht die Möglichkeit zur
Nachbestrahlung der Prostataloge sowie der Lymphabflusswege.
Strahlentherapie / Brachytherapie
Neben einer operativen Entfernung der Prostata ist im lokal begrenzten Stadium auch die Durchführung einer Strahlentherapie oder Brachytherapie in kurativer Intention möglich. Bei der perkutanen Strahlentherapie erfolgt eine bildgestützte Bestrahlung der Prostata von außen. Die Brachytherapie umfasst die – je nach Risikoklassifizierung – dauerhafte, niedrigdosierte (low-dose-rate, LDR) oder vorübergehende, hochdosierte (high-dose-rate, HDR) Implantation der Strahlenquelle in die Prostata.
In beiden Verfahren kann eine zusätzliche, zeitlich begrenzte Androgendeprivationstherapie indiziert sein. Hierbei wird der Testosteronspiegel im Körper medikamentös (orale oder subkutane Applikation) durch Wirkung auf die Hypothalamus-Hypophysen-Gonaden-Achse stark abgesenkt. Mögliche Nebenwirkungen sind u.a. Hitzewallungen, Libidoverlust, erektile Dysfunktion, Dysthymie sowie ein erhöhtes Risiko für kardiovaskuläre Erkrankungen.
Komplikationen der Strahlentherapie und Brachytherapie entstehen durch Strahlenschäden an umliegenden Strukturen. Diese betreffen u.a. den unteren Harntrakt und äußern sich in irritativen und obstruktiven Miktionsbeschwerden, Makrohämaturie, narbigen Strikturen des Blasenhalses oder der Harnröhre sowie Fistelbildungen. Zudem besteht das Risiko für eine Strahlenproktitis des Enddarms resultierend in gehäuftem Stuhldrang und rektalen Blutabgängen.
Auch die strahlenbasierten Therapieoptionen beeinflussen die erektile Funktion und Kontinenz des Patienten. Für die perkutane Strahlentherapie ist das Vorliegen einer höhergradigen Inkontinenz nach 2 Jahren in 0-1% der Fälle, das einer erektilen Dysfunktion in 41% beschrieben.7
Die Progression der Erkrankung und Bildung von Fernmetastasen kann durch die Strahlentherapie im Vergleich zur Active Surveillance verringert werden. Radikale Prostatektomie und Strahlentherapie zeigen hier vergleichbare Ergebnisse.3 Auch nach Strahlen-/Brachytherapie erfolgt die Nachsorge PSA-basiert. Im Falle eines lokalen Rezidivs besteht prinzipiell die Möglichkeit zur Durchführung einer radikalen (Salvage)-Prostatektomie. Aufgrund der lokalen, strahlenassoziierten Veränderungen muss jedoch von einem deutlich erhöhten Operationsrisiko ausgegangen werden.
Zeigt sich nach vorheriger Lokaltherapie ein Progress mit Bildung von Fernmetastasen oder liegt bereits bei Erstdiagnose ein metastasiertes Prostatakarzinom vor besteht die Indikation zur Einleitung einer Systemtherapie.
Die oben beschriebene Androgendeprivationstherapie bildet die Grundlage einer jeden systemischen Prostatakarzinom-Therapie. Mittels Androgen-Target-Therapie können zudem die Androgenrezeptoren in Form einer oralen Medikation blockiert werden. Eine Alternative stellen taxan-basierte Chemotherapien dar. Nach frustranen Vortherapien wird auch eine Radioliganden-Therapie im Sinne einer inneren Bestrahlung eingesetzt.
1 Abuzallouf S, Dayes I, Lukka H (2004) Baseline staging of newly diagnosed prostate cancer: a summary of the literature. J Urol 171:2122-2127
2 D‘amico AV, Whittington R, Malkowicz SB et al. (1998) Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. Jama 280:969-974
3 Hamdy FC, Donovan JL, Lane JA et al. (2016) 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. The New England journal of medicine 375:1415-1424
4 Hofman MS, Lawrentschuk N, Francis RJ et al. (2020) Prostate-specific membrane antigen PET-CT in patients with high-risk prostate cancer before curative-intent surgery or radiotherapy (proPSMA): a prospective, randomised, multicentre study. Lancet 395:1208-1216
5 Klotz L, Zhang L, Lam A et al. (2010) Clinical results of long-term follow-up of a large, active surveillance cohort with localized prostate cancer. J Clin Oncol 28:126-131
6 Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft Deutsche Krebshilfe Awmf) (2021) S3-Leitlinie Prostatakarzinom, Langversion 6.2. In: AWMF-Registrierungsnummer 043/022OL.
7 Vernooij RWM, Cremers R, Jansen H et al. (2020) Urinary incontinence and erectile dysfunction in patients with localized or locally advanced prostate cancer: A nationwide observational study. Urol Oncol 38:735.e717-735.e725









 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
