REALIZE: Telaprevir bei Therapieversagern
In REALIZE wurden 662 vorbehandelte Patienten (88% VL >800.000 IU/ml, 25% Zirrhose) erneut therapiert und zwar entweder
12 Wochen pegIFN/RBV /TVR und 36 Wochen
pegIFN/RBV
4 Wochen
pegIFN/RBV und 12 Wochen pegIFN/RBV/TVR und 32 Wochen pegIFN/RBV
48 Wochen pegIFN/RBV
Rund 25% der Patienten waren in der Vortherapie Nullresponder (Abfall HCV-VL <1log), etwa 29% partielle Responder (Abfall HCV-VL >2log) und mehr als 50% Relapser.
Ergebnisse
Die SVR-Raten waren
- bei den Relapsern 83% bzw. 88% vs 24%
- bei den partiellen Respondern 59% bzw. 54% vs 15%
- bei den Nullrespondern 29% bzw. 33% vs. 5%
Patienten mit Gentotyp 1a und 1b sprachen gleichermaßen gut an.
Patienten mit fortgeschrittener Leberfibrose/Zirrhose und schlechtem Ansprechen in der Vortherapie protifierten zwar von der Triple-Therapie erreichten aber insgesamt schlechtere Ansprechraten. In dieser Gruppe waren allerdings nur wenig Patienten, so dass eine zuverlässige Aussage nicht möglich ist.
Die Lead-in Phase hatte keinen Einfluss auf die SVR-Rate, virologische Durchbrüche oder Relapse.
Nebenwirkungen
Zusätzliche Nebenwirkungen durch Telaprevir
waren (wie in den früheren Studien auch) in erster Linie Müdigkeit, Anämie
(kein EPO, 6% Grad 3, 25% Reduktion der RBV-Dosis), Hautausschläge (3% Grad 3,
5 Abbrüche) und Juckreiz, anale Beschwerden (Juckreiz, „discomfort“,
Hämorrhiden – 3 Abbrüche deswegen) sowie Durchfälle.

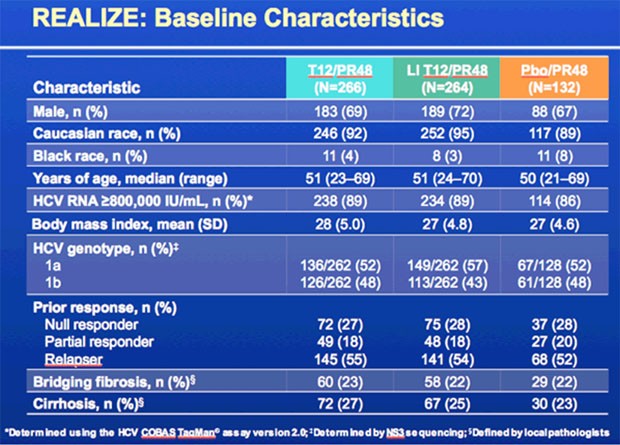
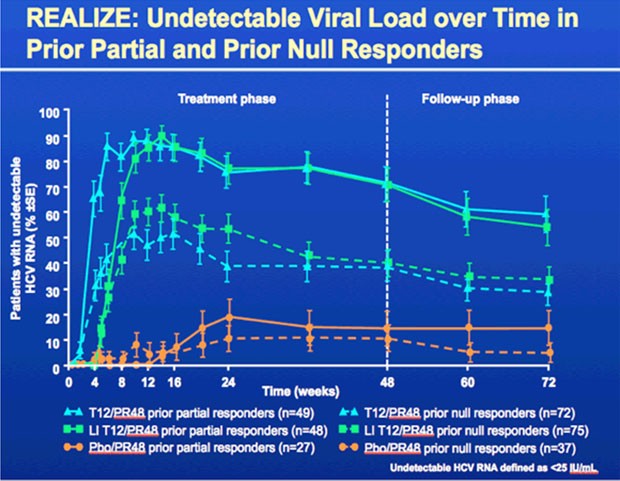
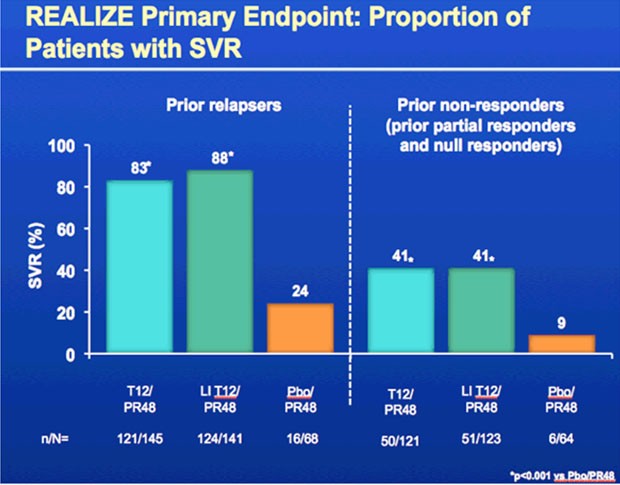
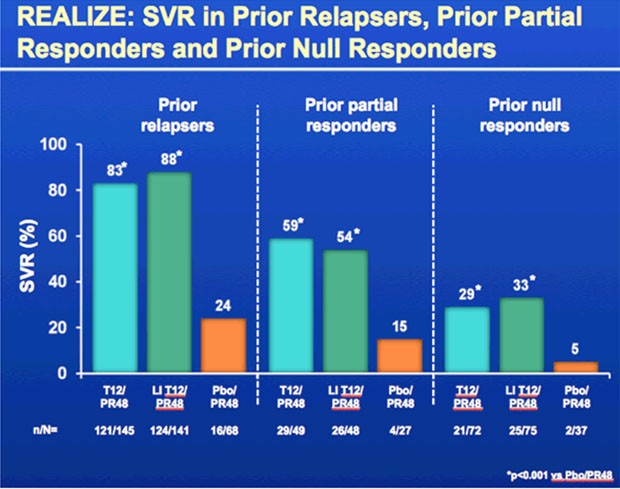
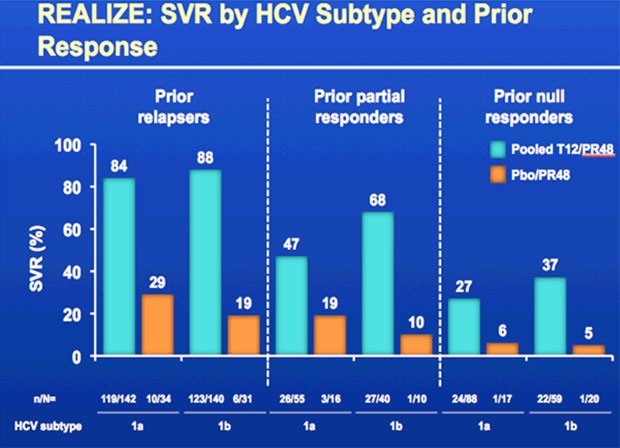
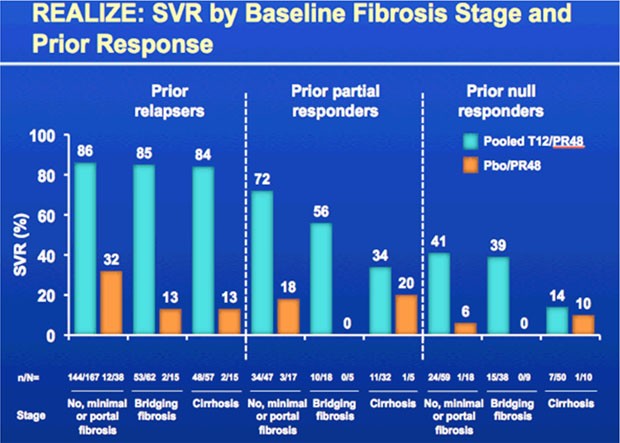
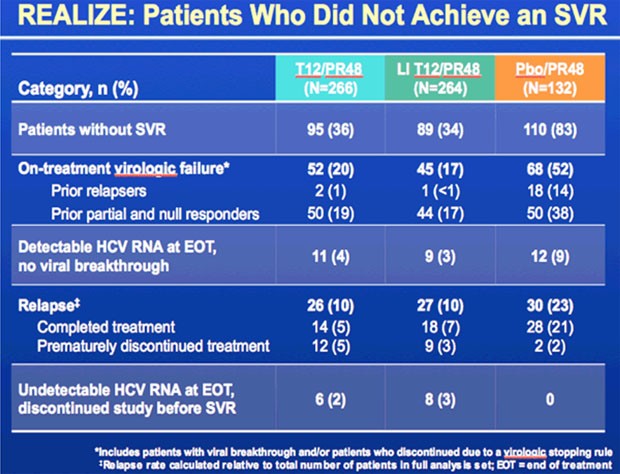
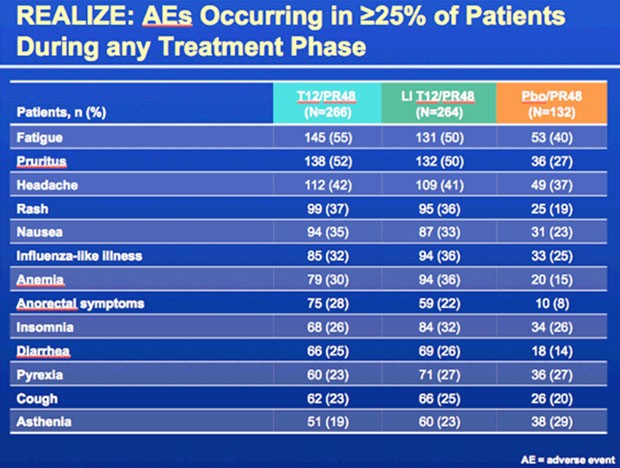
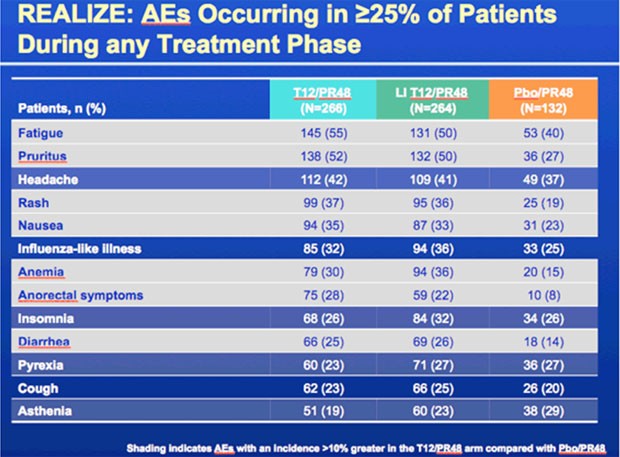


Abb. www.natap.org
Zeuzem S et al. REALIZE Trial Final Results: Telaprevir-based Regimen for Genotype 1 Hepatitis C Virus Infection in Patients with Prior Null Response, Partial Response or Relapse to Peginterferon/Ribavirin. EASL The international Liver Congress 2001/46th Annual Meeting of the European Association for the Study of the Liver. 30.3.-2.4.2011 in Berlin. Abstract 5.









 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
